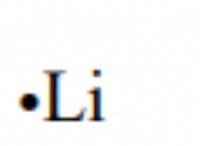1. 방향족 고리 :
* 방향족 화합물은 교류 이중 및 단일 결합을 갖는 순환 구조를 포함하여 공액 시스템을 형성한다.
*이 시스템은 전자의 비편성으로 인해 방향족이라고하는 특별한 안정성을 만듭니다.
* 이러한 안정성을 달성하기 위해, 방향족 고리는 특정 비율의 탄소 대 수소 원자를 갖는다.
2. 알칸 vs. 방향족 :
* Alkanes 포화 탄화수소는 탄소 골격에 가능한 최대 수소 원자 수가 있음을 의미합니다. 그들은 일반적인 공식 C n 를 따릅니다 H 2n+2 .
* 방향족 화합물 탄소 고리에 부착 된 수소 원자가 더 적기 때문에 수소 대 탄소 비율이 낮습니다. 이는 링 내에 비편정 된 PI 시스템을 형성하기 위해 일부 결합 용량을 사용하기 때문입니다.
예 :
* 벤젠 (c 6 H 6 ) 간단한 방향족 화합물입니다. C :H 비율은 1 :1입니다.
* 헥산 (c 6 h 14 ) , 간단한 알칸은 C :H 비율이 3 :7입니다.
요약 :
방향족 화합물에서 하부 C :H 비는 방향족 고리의 독특한 구조적 특징으로부터 발생하며, 이는 부착 된 수소 원자의 수를 최대화하는 데있어 안정적인 비 반사화 된 PI 시스템의 형성을 우선 순위를 지정한다.