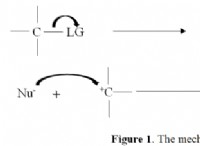
다음은 고장입니다.
* 중간체 반응물이나 생성물이 아닌 반응 동안 형성된 일시적인 종이다. 그것들은 더 반응하기 전에 짧은 시간 동안 만 존재합니다.
* 반응 메커니즘 : 많은 반응이 여러 단계를 통해 발생하며,이 단계에서 중간체가 형성됩니다. 이 단계는 함께 반응 메커니즘을 구성합니다.
* 예 : 메탄 (CH4)의 연소를 고려하십시오.
* 1 단계 : CH4 + O2 → CH3 + H + O2
* 2 단계 : CH3 + O2 → CH2O + OH
* 3 단계 : CH2O + O2 → H2O + CO2
* 전반적인 반응 : CH4 + 2O2 → CO2 + 2H2O
이 메커니즘에서 CH3, OH 및 CH2O는 중간체입니다.
왜 중간체가없는 것처럼 보일지 :
* 속도 : 중간체는 종종 반응성이 높고 수명이 짧습니다. 그것들은 그들이 형성되는만큼 빨리 소비 될 수 있으므로 감지하거나 분리하기가 어려울 수 있습니다.
* 전반적인 반응에 중점을 둡니다 : 종종 우리는 중간체를 보여주지 않는 전체 균형 방정식에 중점을 둡니다.
* 단순화 : 어떤 경우에는 단순성을 위해, 우리는 특히 입문 화학에서 반응 표현으로부터 중간체를 생략 할 수있다.
요약 : 중간체는 반응 메커니즘을 이해하는 데 필수적입니다. 그것들이 일시적이고 감지하기 어려울 수 있지만, 반응물을 생성물로 변환하는 과정에 그들의 존재가 중요합니다.