* 하나의 양성자와 하나의 전자 : 수소는 전자가 하나만있어 전자 (할로겐처럼)를 쉽게 얻거나 전자를 잃을 수 있습니다 (알칼리 금속처럼).
* 코어 전자 없음 : 다른 원소와 달리, 수소에는 내부 전자가 없으므로 단일 전자가 접착에 쉽게 접근 할 수 있습니다.
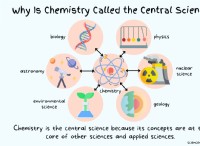
수소가 그룹 1 :에 배치되는 이유
* 전자 구성 : 수소는 리튬 (LI), 나트륨 (NA) 및 칼륨 (k)과 같은 알칼리 금속과 유사한 가장 바깥 쪽 쉘에 단일 전자를 갖는다. 이 공유 구성은 비금속과 이온 성 화합물을 형성하는 것과 같은 특정 반응에서 유사한 반응성을 초래합니다.
* 이온 결합 : 수소는 전자를 잃고 알칼리 금속이 양이온을 형성하는 것과 유사한 양의 이온 (H+)을 형성 할 수 있습니다. 이온 행동의 이러한 유사성은 전통적으로 그룹 1에 배치 된 이유입니다.
수소가 할로겐처럼 작용하는 이유 :
* 전자 친화력 : 수소는 상대적으로 높은 전자 친화력을 가지며, 이는 전자를 쉽게 이득하여 헬륨 (HE)과 유사한 안정적인 전자 구성을 달성합니다. 이 거동은 불소 (F), 염소 (CL) 및 브롬 (BR)과 같은 할로겐의 특징입니다.
* 공유 결합 : 수소는 다른 원자와 단일 전자를 공유하여 할로겐처럼 공유 결합을 형성 할 수 있습니다. 이것은 수소 할라이드 (예를 들어, HCL)의 형성에서 예시된다.
결론 :
주기율표에서 수소의 독특한 위치는 전자를 얻거나 잃는 능력에서 발생합니다. 그룹 1과 그룹 17과 일부 속성을 공유하지만 궁극적으로 그룹에 속하지 않습니다. 일부 화학자들은 별개의 행동을 인정하면서 개별적으로 배치하는 것을 선호합니다.



![[비디오] 넓은 일광에서 볼 수 있듯이 ISS 및 Atlantis 셔틀](/article/uploadfiles/202211/2022111014562385_S.jpg)