염은 산과 염기 사이의 중화 반응에 의해 형성된 화합물이다. 그들은 일반적으로 물에서 이온화되어 양이온과 음이온을 생성합니다. 소금 이온화 동안 형성된 양이온 또는 음이온은 수용액에서 수화 된 이온으로서 존재하거나 물과 상호 작용하여 산 및 염기를 재생한다. 양이온 또는 음이온과 물 사이의 염 상호 작용 과정은 염 가수 분해로 알려져 있습니다. 가수 분해에 기초하여, 염은 세 가지 범주로 분류됩니다.
-
산성 염
-
기본 소금
-
중성 소금
가수 분해에 기초한 염의 유형
-
강산 및 강한 염기의 염 :강산과 강한 염기의 중화에 의해 형성된 염은 기본적으로 중립적이기 때문에 결합이 염 용액에서 깨지지 않기 때문입니다. 일반적으로 수화되지만 가수 분해되지 않습니다. 따라서, 이러한 염은 일반적으로 중성 소금으로 알려져있다. 예를 들면 :naCl
NaCl은 물에 분리되어 Na + 및 Cl – 이온을 형성합니다.
이들 이온이 물과 반응하면 생성물은 NaOH 및 HCl이된다. 이들은 강한 전해질이며 완전히 이온화됩니다. H + 및
oh- 이온을 재조합하여 해제되지 않은 물 분자를 형성합니다. 중립적입니다.
-
약산 및 강한 염기의 염 :약산과 강한 염기의 중화에 의해 형성된 염은 기본적으로 기본적입니다. 예를 들어, ch3coona
ch3coona → ch3coo– + na
ch3coo – + h2o ↔ ch3cooh + oh-
∴ [OH-]> [h+] 따라서 솔루션은 기본적입니다
아세트산은 약산이며 용액에 결합되지 않습니다. 이것은 옴의 농도를 증가시키고 용액을 알칼리성으로 만듭니다. 용액의 pH는 7보다 큽니다.
-
강산 및 약한 염기의 염 :강산 및 약한 염기의 중화에 의해 형성된 염은 본질적으로 산성입니다. 예를 들어 :NH4CL
NH4CL의 가수 분해는 다음과 같이 표현 될 수 있습니다.
nh4cl + h2o ↔ nh4oh + hcl
또는 nh4 + + cl- + h2o ↔ nh4oh + h + + cl-
H+이온을 생성함에 따라 그러한 소금의 용액은 특성상 산성입니다.
암모니아 수산화암은 약한 염기이며 용액에 균일하게 유지됩니다. 이것은 H+ 이온의 농도를 증가시키고 용액을 산성으로 만듭니다. 이러한 용액의 pH는 7 미만입니다.
-
약산 및 약한 염기의 염 :약산 및 염기의 중화에 의해 형성된 염은 관련 산 및 염기의 특성에 따라 산성, 기본 또는 중성입니다. 예를 들면 :CH3COONH4
이기 때문에 중립적입니다
ch3coonh4 → ch3coo– + nh4 +
ch3coo – + h2o ↔ ch3cooh + oh-
nh4 + + h2o ↔ nh4oh + h +
두 반응 모두 같은 속도로 발생하므로 용액은 자연에서 중립적입니다.
소금 방정식의 가수 분해
염은 산과 염기가 서로 중화 될 때 형성된 이온 성 화합물입니다. 식염수는 항상 중립적으로 보이지만 종종 산성이거나 기본적입니다.
약한 산성 히드로 플루오르 산이 강한 염기 나트륨에 의해 중화 될 때 형성된 염을 고려하십시오. 분자 공식과 순 이온 공식은 다음과 같습니다.
hf (aq) + naoh (aq) → NAF (aq) + H2O (l)
hf (aq) + oh– (aq) → f– (aq) + h2o (l)
불화 나트륨은 가용성이기 때문에 중화 반응을위한 관중 이온입니다. 불소 이온은 양성자를 받아 들여 물과 약간 반응 할 수 있습니다.
f– (aq) + h2o (l) ↔ hf (aq) + oh– (aq)
불소 이온은 약한 브론 스테드 끈 염기로 작용합니다. 상기 반응의 결과로 생성 된 수산화 이온은 용액을 약간 기본적으로 만듭니다. 염 가수 분해는 소금 이온 중 하나가 물과 반응하여 산성 또는 기본 용액을 형성하는 반응입니다.
기본 용액을 형성하는 소금
고체 불화 나트륨이 물에 용해되면 나트륨과 불화 이온으로 완전히 분리됩니다. 나트륨 이온은 가수 분해 될 수 없지만 불소 이온이 가수 분해하여 소량의 수평가 산 및 수산화물 이온을 생성합니다.
f– (aq) + h2o (l) ↔ hf (aq) + oh– (aq)
강한 염기 (NaOH)로 약산 (HF)을 중화 시켜서 항상 기본 염 용액을 생성합니다.
산성 용액을 형성하는 염
염화 암모늄 (NH4CL)은 강산 HCl이 약한 염기 NH3에 의해 중화 될 때 형성된 염입니다. 염화 암모늄은 수용성입니다. 생성 된 클로라이드 이온은 강산 HCl의 컨쥬 게이트 염기이며 가수 분해 될 수 없다. 다시 말해, 클래온은 이전 섹션에서 불소 이온과 마찬가지로 물에서 물에서 양성자를받을 수 없다. 그러나 암모늄 이온은 물과 쉽게 반응하여 양성자를 기증 할 수 있기 때문에 산 역할을합니다.
nh4 + (aq) + h2o (l) ↔ h3o + + nh3 (aq)
천연 용액을 형성하는 소금
강한 염기와의 반응으로 인한 염은 pH 7에서 용액을 형성한다. NaCl 수용액은 두 이온을 가수 분해 할 수 없기 때문에 산성이거나 기본적이지 않습니다. 중성 용액을 형성하는 다른 염에는 질산 칼륨 (KNO3) 및 리튬 브로마이드 (LIBR)가 포함됩니다.
가수 분해 반응이 양이온과 음이온 사이에 경쟁하기 때문에 약산과 약한 염기의 반응으로 형성된 염은 분석하기가 더 어렵다.
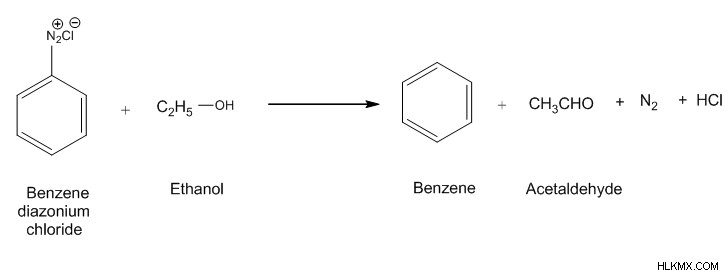
벤젠 디아조늄 클로라이드의 가수 분해
벤조 렌디 아 조간 클로라이드가 가수 분해 될 때 질소 분자는 질소 가스로 탈출합니다. 물의 OH 그룹은 질소 가스 제거 후에 남아있는 공석을 공격합니다. 이것은 페놀의 형성으로 이어진다.
결론
염은 양이온 및 음이온으로 구성된 이온 성 화합물이며, 각각은 물과의 산 또는 염기 이온화 반응을 유발할 수 있습니다. 따라서, 수성 염 용액은 염의 구성 이온의 상대적인 산-염기 강도에 따라 산성, 기본 또는 중성 일 수있다. 순수한 물은 약한 전해질입니다. 수소와 수산화수소로 완전히 분리되지는 않지만이 두 이온과 평형에 존재하기 때문에 약합니다. 본질적으로 중립적입니다. H+ 이온 농도는 OH 이온 농도와 정확히 동일합니다. 이 조건이 이온의 농도를 감소시켜 방해 받으면, 중성 특성은 산성 또는 기본으로 변합니다. [h+]> [OH]이면 물은 산성이됩니다. [h+] < [OH], 물은 기본이 될 것입니다. 이것은 정확히 염 가수 분해로 알려진 현상 중에 발생하는 변화입니다. 이는 염의 양이온 및 / 또는 음이온이 물과 반응하여 산 또는 알칼리성을 생성하는 반응으로 정의됩니다.