이유는 다음과 같습니다.
* 많은 염기는 다 원자 이온이 아닙니다. 일반적인 예는 다음과 같습니다.
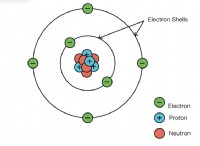
* 수산화 이온 (OH-) 많은 염기에서 발견되는 다 원자 이온이지만 전부는 아닙니다.
* 금속 수산화물 (Naoh, Koh) 수산화물 이온을 함유하는 이온 성 화합물이다.
* 암모니아 (NH3) 다 원자 이온이 아닌 약한 염기와 분자입니다.
* 유기 아민 (예 :메틸 아민, CH3NH2) 또한 기초와 분자입니다.
* 다 원자 이온은 산성이거나 기본적 일 수 있습니다. 예를 들어, 탄산염 이온 (CO3^2-)은 일부 반응에서 기초로 작용할 수 있습니다.
요약 : 수산화물 이온은 많은 염기에서 일반적이지만, 모든 염기가 포함되는 것은 아니며, 모든 다 원자 이온이 기본적인 것은 아닙니다. 염기의 정의 특성은 특정 이온의 특정 존재가 아니라 양성자를 받아들이는 능력입니다.