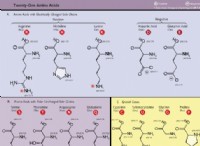
* 원자 밀도 : 금속이 다른 밀도를 가지며, 이는 주어진 부피에 포장 된 원자의 수가 다양합니다.
* 원자가 전자 : 원자 당 원자가 전자 (가장 바깥 쪽 쉘의 전자)의 수도 다양합니다. 이 전자는 전자 전기성에 기여하는 전자입니다.
이 문제에 접근 할 수있는 방법은 다음과 같습니다.
1. 금속을 선택하십시오 : 구리를 예로 들어 봅시다.
2. 밀도 : 구리의 밀도는 약 8.96 g/cm³입니다.
3. 원자 무게 : 구리의 원자 중량은 63.55 g/mol입니다.
4. Avogadro의 번호 : Avogadro의 숫자 (6.022 x 10²³ 원자/mol)를 사용하여 그램을 원자로 변환하십시오.
5. 원자가 전자 : 구리에는 하나의 원자가 전자가 있습니다.
계산 :
* 1 cm³의 원자 :
- (8.96 g/cm³)/(63.55 g/mol) * (6.022 x 10²³ Atoms/mol) ≈ 8.49 x 10²² 원자
* 1 cm³의 전자 :
- (8.49 x 10²² 원자) * (1 원자가 전자/원자) ≈ 8.49 x 10²² 전자
중요한 참고 : 이 계산은 대략적인 전자 수를 제공합니다. 실제 숫자는 결정 구조 및 온도와 같은 요인으로 인해 약간 달라질 수 있습니다.
일반 공식 :
이 일반적인 공식을 모든 금속에 적용 할 수 있습니다.
```
전자 수 =(금속의 밀도 / 금속의 밀도) * Avogadro의 수 * 원자가 전자 수
```