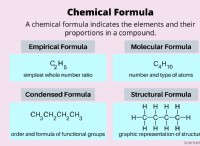
1. 전자 전환
* 무색 화합물 : 화합물에 빛이 비치면 전자가 에너지를 흡수하고 더 높은 에너지 수준 (여기 상태)으로 점프 할 수 있습니다. 무색 화합물의 경우, 접지 상태와 여기 상태 사이의 에너지 차이는 가시 광선 스펙트럼을 벗어납니다. 이것은 화합물이 우리가 볼 수없는 자외선 또는 적외선을 흡수한다는 것을 의미합니다.
* 컬러 화합물 : 컬러 화합물은 가시 스펙트럼 (400-700 nm 사이의 파장)에서 빛을 흡수 할 수있는 전자를 갖는다. 이 흡수는 화합물에 색상을주는 것입니다. 우리가 인식하는 특정 색상은 흡수 된 빛의 상보적인 색입니다. 예를 들어, 붉은 빛을 흡수하는 물질은 녹색으로 보입니다.
2. 분자 구조 및 결합
* 접합 시스템 : 교대 단일 및 이중 결합 (공액 시스템)을 갖는 화합물은 종종 비편성 전자를 갖는다. 이들 전자는 가시 스펙트럼에서 빛을 흡수하여 화합물을 착색시킬 수있다. 공액 시스템이 더 광범위할수록 전자 전이에 필요한 에너지가 낮아지고 빛의 파장이 더 길어 흡수되어 붉은 색으로 이어집니다.
* 금속 이온 : 많은 전이 금속 이온 (예를 들어, 구리, 크롬, 철)은 부분적으로 채워져있는 d- 궤도가 있습니다. 이 궤도는 가시 영역에서 빛을 흡수하여 밝은 색의 화합물을 초래할 수 있습니다. 특정 색상은 금속, 산화 상태 및 주변의 리간드에 따라 다릅니다.
* 발색단 : 가시 영역에서 빛을 흡수하는 것을 담당하는 분자 내의 특정 원자 그룹을 발색단이라고합니다. 이들 그룹은 종종 공액 시스템 또는 금속 이온을 포함한다.
3. 환경 적 요인
* 용매 : 화합물이 용해되는 용매는 그 색상에 영향을 줄 수 있습니다. 용매 상호 작용은 전자의 에너지 수준을 이동하여 흡수 된 빛의 파장에 영향을 줄 수 있습니다.
* pH : pH의 변화는 분자의 구조를 변화시켜 빛을 흡수하는 능력에 영향을 줄 수 있습니다. 예를 들어, 많은 지표는 환경의 산도 또는 알칼리도에 따라 색상이 변합니다.
예 :
* 무색 : 물 (H2O), 메탄 (CH4), 테이블 소금 (NACL)
* 색상 : 구리 황산염 (CUSO4)은 파란색이고, 식물의 엽록소는 녹색이고, 당근의 베타 카로틴은 오렌지이며, 칼륨 과망간산산염 (KMNO4)은 자주색입니다.
요약 :
화합물의 색은 가시 스펙트럼에서 빛을 흡수하는 능력에 의해 결정됩니다. 이 능력은 분자 내 전자 전이, 특정 분자 구조 및 결합 및 환경 적 요인에 의해 영향을받습니다. 무색 화합물에는 필요한 전자 전환이 없거나 가시 범위를 벗어납니다.