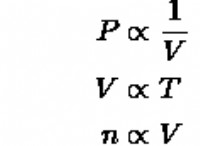이유에 대한 분석은 다음과 같습니다.
* 전체 원자가 쉘 : 모든 고귀한 가스는 가장 바깥 쪽 껍질에 8 개의 전자가 있습니다 (헬륨 제외, 2 개가 있음). 이 구성은 전자적으로 안정적인 것으로 간주됩니다 화학적 결합을 형성하기 위해 전자를 쉽게 받아들이거나 기증하지 않습니다.
* 높은 이온화 에너지 : 안정적인 전자 구성으로 인해 고귀한 가스 원자에서 전자를 제거하려면 상당한 양의 에너지가 필요합니다. 이것은 양성 이온을 형성하는 데 매우 저항력이 있습니다.
* 낮은 전자 친화력 : 고귀한 가스는 외부 껍질이 이미 가득 차기 때문에 전자를 얻는 경향이 낮습니다. 이것은 음성 이온을 형성하지 않을 것입니다.
그러나, 고귀한 가스조차도 극한 조건 하에서 화합물을 형성하는 데 동축 될 수 있다는 점에 유의해야한다. 예를 들어:
* Xenon 불소와 같은 강한 산화제에 노출 될 때 Xefs (Xenon Difluoride) 및 Xeo₂ (Xenon 이산화물)과 같은 화합물을 형성 할 수 있습니다.
* 아르곤 극한 조건에서 맹렬한 화합물 인 Arh⁺ (아르곤 수 소화물)를 형성하는 것으로 관찰되었다.
따라서 탁월한 반응성 부족으로 인해 종종 "불활성 가스"라고 불리지만 정상적인 조건에서 고귀한 가스가 극도로 반응하지 않는다고 말하는 것이 더 정확합니다 . .