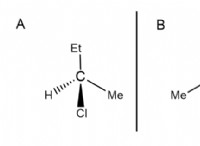
* 가스의 산도 및 염기성 : 산성 또는 기본 용액을 형성하는 가스의 능력은 화학적 특성에 따라 다릅니다.
* 산성 가스 : 물에 용해 될 때 일부 가스는 수소 이온 (H+)을 방출하여 용액을 산성으로 만듭니다. 예제는 다음과 같습니다.
* 이산화탄소 (CO2) : 물에 탄산 (H2CO3)을 형성하여 용액을 약간 산성으로 만듭니다.
* 이산화황 (SO2) : 물에 황산 (H2SO3)을 형성하여 용액을 산성으로 만듭니다.
* 기본 가스 : 물에 용해 될 때 다른 가스는 수산화물 이온 (OH-)을 방출하여 용액을 기본으로 만듭니다. 예는 다음과 같습니다.
* 암모니아 (NH3) : 수산화 암모늄 (NH4OH)을 물에 형성하여 용액을 약간 기본적으로 만듭니다.
* 중성 가스 : 일부 가스는 물과 크게 상호 작용하여 산이나 염기를 형성하지 않습니다. 예제는 다음과 같습니다.
* 질소 (N2) : 물에 대해 매우 반응하지 않습니다.
* 산소 (O2) : 물에 약간 용해되지만 pH에 크게 영향을 미치지 않습니다.
따라서 가스를 용해시킴으로써 형성된 용액의 중립성은 가스의 화학적 특성과 물과 반응하여 산 또는 염기를 형성하는 능력에 달려있다. .
수용액이 산성, 기본 또는 중립인지 여부를 결정하기 위해 문제의 특정 가스를 고려하는 것이 중요합니다.