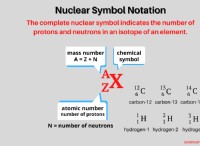
이유는 다음과 같습니다.
* 자발적 반응 : 이러한 반응은 외부의 에너지 입력없이 자연스럽게 발생합니다. 그들은 낮은 에너지 상태로 진행하는 경향이 있습니다.
* 반응의 열 (ΔH) : 이 값은 반응 동안 흡수되거나 방출되는 열의 양을 나타냅니다.
* 음성 ΔH : 열이 반응 (발열 반응)에 의해 방출됨을 나타냅니다. 이는 시스템이 에너지를 방출하고 낮은 에너지 상태로 이동함에 따라 자발성에 유리합니다.
* 양성 ΔH : 열이 반응에 의해 흡수됨을 나타냅니다 (흡열 반응). 시스템이 진행하기 위해 에너지가 필요하므로 자발성에 바람직하지 않습니다.
중요한 참고 : 부정적인 ΔH는 자발성의 좋은 지표이지만 유일한 요인은 아닙니다. 깁스 자유 에너지의 변화 (ΔG) 자발성의 진정한 결정 요인입니다.
* ΔG <0 : 자발적 반응
* ΔG> 0 : 자발적인 반응
* ΔG =0 : 평형
Gibbs Free Energy 방정식은 엔탈피 변화 (ΔH)와 엔트로피 변화 (ΔS)를 모두 포함합니다.
ΔG =ΔH- TΔS
어디:
* t =켈빈의 온도
따라서, 반응의 양성 ΔH (흡열)가 있더라도 엔트로피 변화 (ΔS)가 충분히 양성인 경우에도 자발적 일 수 있으며 음성 ΔG를 유발할 수 있습니다.