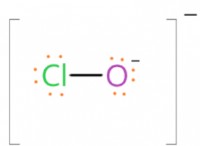이유는 다음과 같습니다.
* 중앙 원자 : 요오드 (I)는 중앙 원자입니다.
* 원자가 전자 : 요오드는 7 개의 원자가 전자를 가지며 각 염소 원자는 7을 갖는다.
* 총 원자가 전자 : 7 (i) + 5*7 (cl) =42
* 루이스 구조 : ICL5의 루이스 구조는 5 개의 염소 원자에 결합 된 요오드를 나타내며, 요오드에 1 개의 고독 쌍이 나타납니다.
* VSEPR 이론 : VSEPR 이론은 반발을 최소화하기 위해 중앙 원자 주위의 전자 쌍의 배열을 예측한다. 이 경우, 5 개의 결합 쌍과 요오드 원자 주위의 1 개의 고독 쌍은 사각형 피라미드 배열로 이어진다.
키 포인트 :
* 요오드 원자의 고독한 쌍은 염소 원자에 의해 형성된 제곱 염기 위에 위치합니다.
* 클로린 원자 사이의 결합 각도는 고독한 쌍의 반발로 인해 90도 미만입니다.
참고 : 분자 형상은 고독한 쌍이 아닌 원자의 배열 만 설명합니다.