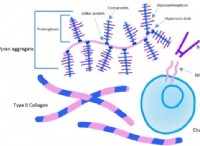
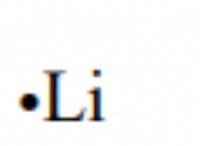트렌드 :
* 끓는점과 융점이 증가함에 따라 그룹 17 (halogens).
설명 :
경향은 할로겐 분자 사이의 분자간 힘의 강도가 증가함에 따라 발생합니다. 이유는 다음과 같습니다.
* van der waals 세력 : 할로겐 분자들 사이의 1 차 분자간 힘은 런던 분산 력 (반 데르 발스 힘의 유형)이다. 이 힘은 분자 내의 전자의 움직임으로 인해 발생하는 일시적이고 변동하는 쌍극자로부터 발생합니다.
* 분극성 : 그룹을 아래로 이동하면 할로겐 원자가 커집니다. 이것은 더 많은 전자를 가지고 있으며, 이들 전자는 핵에서 더 나아졌다. 이로 인해 전자 구름이 더 쉽게 왜곡됩니다 (편광 가능).
* 더 강한 런던 분산 세력 : 분극성이 커지면 임시 쌍극자가 더 강해져 런던 분산력이 더 강해집니다.
* 더 높은 에너지 필요 : 더 강한 분자간 힘은 극복하기 위해 더 많은 에너지가 필요합니다. 이로 인해 끓는점이 높아지고 녹는 점이 더 높아집니다.
요약 :
1. 큰 원자 =더 많은 전자 =더 많은 분극 가능한 전자 구름.
2. 더 많은 분극 가능한 전자 구름 =더 강한 런던 분산 힘.
3. 더 강한 분자간 힘 =더 높은 끓는 지점 및 용융점.
예 :
* 불소 (F2)는 원자가 작고 런던 분산 힘이 약하기 때문에 비등점 (-188 ° C)이 가장 낮습니다.
* 요오드 (i2)는 원자가 크고 런던 분산 힘이 강하기 때문에 비등점 (184 ° C)이 가장 높습니다.
특정 할로겐을 탐색하거나 분자간 힘의 세부 사항을 더 깊이 파고 들려도 알려주세요!