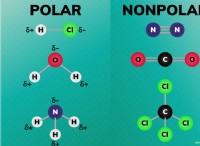
강산 대 약산 및 전도도
* 강산 (HCL, HNO₃, HASSO₄와 같은) 용액에서 완전히 이온화. 이것은 그들이 이온으로 분리 된 것을 의미합니다.
* 약산 (아세트산과 유사) 용액에서만 부분적으로 이온화됩니다. 그것들은 평형으로 존재하며, 분자의 작은 부분 만 이온으로 부러집니다.
전도도 및 이온
* 용액의 전기 전도도는 존재하는 이온의 수와 직접 관련이 있습니다. 용액에서 이온이 많을수록 전기를 더 잘 수행합니다.
답변
강산의 0.1m 용액은 약산의 1m 용액보다 더 나은 도체가 될 것이다.
* 강산은 농도가 훨씬 높을 것입니다. 완전히 이온화되기 때문에 0.1m 강산은 0.1m h⁺ 이온을 갖습니다.
* 약산은 농도가 훨씬 낮을 것입니다. 비록 전체 농도 전체 (1m)이지만, 약산 분자의 작은 부분만이 실제로 H⁺와 음이온으로 이온화 될 것이다.
중요한 참고 : 0.1m 강산은 1m의 약산보다 더 나은 도체가 될 것이지만, 전도도는 또한 특정 산 및 온도에 의존 할 수있다.
다른 질문이 있으면 알려주세요!