주요 차이 - 동위 원소 대 이소 바르
화학 요소의 원자는 항상 전자 구름으로 둘러싸인 핵으로 구성됩니다. 핵은 양성자와 중성자로 구성됩니다. 특정 요소의 원자에 존재하는 양성자의 수는 항상 동일합니다. 이것은 양성자의 수가 화학 요소의 독특한 특성임을 의미합니다. 그러나, 핵에 존재하는 중성자의 수는 동일한 요소의 원자에서 달라질 수있다. 이러한 다른 형태를 동위 원소라고합니다. 특정 요소의 원자 질량은 그 요소의 핵에서 양성자와 중성자의 합입니다. 때로는 원자 숫자가 서로 다르지만 다른 요소의 원자 질량은 동일 할 수 있습니다. 이러한 다른 형태를 이소 바라고합니다. 동위 원소와 이소 바의 주요 차이점은 동위 원소의 원자 질량은 서로 다르고 이소 바의 원자 질량은 서로 비슷하다는 것입니다.
주요 영역을 다루었습니다
1. 동위 원소
- 정의, 속성, 예
2. 이소 바르 란?
- 정의, 속성, 예
3. 동위 원소와 이소 바의 차이점은 무엇입니까
- 주요 차이점 비교
주요 용어 :원자 질량, 원자 번호, 동위 원소, 동위 원소, 핵, 중성자, 양성자 
동위 원소
동위 원소는 동일한 요소의 다른 원자 구조입니다. 이것은 동위 원소가 원자 수가 같지만 원자 질량이 다르다는 것을 의미합니다. 원자 수는 핵에 동일한 수의 양성자가 있기 때문에 화학 요소의 고유 한 특성이기 때문입니다. 그러나 원자 질량은 핵에 존재하는 중성자의 수에 의존하고 동위 원소는 다른 수의 중성자를 갖기 때문에 동위 원소의 원자 질량은 서로 다를 수 있습니다.
동위 원소는 요소의 화학적 특성이 주로 원자에 존재하는 전자에 의존하기 때문에 화학적 특성에서 유사성을 나타냅니다. 원소의 동위 원소는 동일한 수의 전자와 동일한 전자 구성을 갖습니다.
동위 원소의 물리적 특성은 서로 다를 수 있습니다. 일반적으로, 물리적 특성은 원자 질량에 의존하고 동위 원소는 원자 질량이 다릅니다. 동위 원소의 일부 예에는 수소, 헬륨, 탄소, 리튬 등의 동위 원소가 포함됩니다.
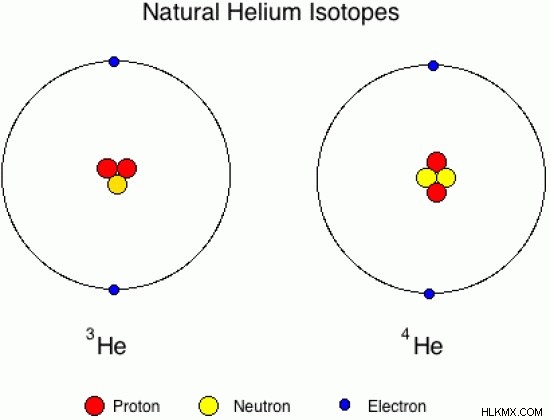
그림 01 :헬륨의 자연적으로 발생하는 동위 원소
위의 이미지는 자연적으로 발생하는 동위 원소의 원자 구조를 보여줍니다. 여기서, 하나의 헬륨 동위 원소는 1 개의 중성자로 구성되는 반면, 다른 하나는 2 개의 중성자로 구성됩니다. 그러나 둘 다 동일한 원자 번호, 2. 원자 질량은 다릅니다.
isobars
isobars는 동일한 원자 질량을 가진 화학 요소입니다. 화학 요소의 원자 질량은 양성자 및 중성자 수의 합에 의해 주어진다. 양성자 또는 중성자만으로는 핵 입니다. . 따라서, 핵의 수는 원자 질량과 같습니다. 따라서 이소 바르는 같은 수의 핵을 가지고 있습니다. 그러나 양성자와 중성자의 수는 항상 이소 바르에서 서로 다릅니다.
isobars는 동일한 수의 전자로 구성됩니다. 이것은 Isobars가 동일한 화학적 특성을 나타냄을 나타냅니다. 원자 질량이 동일하기 때문에 물리적 특성도 동일합니다. 원자 숫자는 다르기 때문에 이소 바는 다른 화학 요소입니다.
예 :원자 질량이 64 인 일련의 이소 바르.
- 코발트 (Co)
- 니켈 (NI)
- 구리 (Cu)
- 철 (Fe)
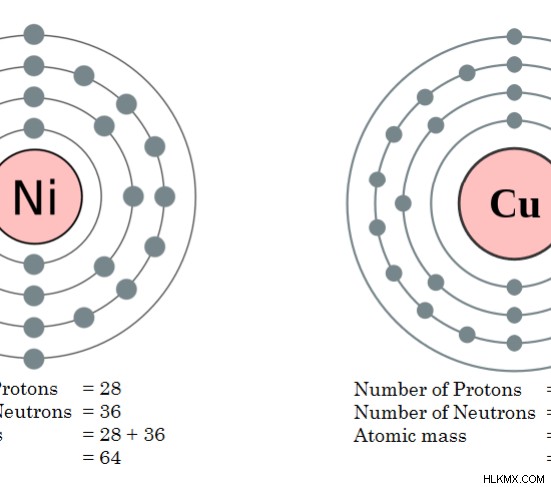
그림 2 :구리와 니켈의 원자 질량
원자 질량을 가진 이소 바르 3.
- 수소 (H)
- 헬륨 (HE)
동위 원소와 이소 바의 차이
정의
동위 원소 : 동위 원소는 동일한 요소의 다른 원자 구조입니다.
이소 바르 : 이소 바는 동일한 원자 질량을 가진 화학 요소입니다.
원자 번호
동위 원소 : 동위 원소의 원자 수는 서로 동일합니다.
이소 바르 : 이소 바의 원자 수는 서로 다릅니다.
원자 질량
동위 원소 : 동위 원소의 원자 질량은 서로 다릅니다.
이소 바르 : 이소 바의 원자 질량은 서로 동일합니다.
화학 요소
동위 원소 : 동위 원소는 다른 형태의 동일한 화학 요소입니다.
이소 바르 : 이소 바르는 다른 화학 요소입니다.
물리적 특성
동위 원소 : 물리적 특성은 동위 원소에서 서로 다릅니다.
이소 바르 : 물리적 특성의 대부분은 이소 바에서 유사합니다.
결론
동위 원소와 이소 바는 화학 요소 간의 관계의 예입니다. 동위 원소는 동일한 화학 요소의 다른 형태를 나타냅니다. Isobars는 동일한 속성을 공유하는 다른 화학 요소 사이의 관계를 나타냅니다. 따라서 동위 원소와 이소 바의 차이를 이해하는 것이 매우 중요합니다.
참조 :
1. "이소 바가 뭐야?" stuy.com. study.com, n.d. 편물. 여기에서 사용할 수 있습니다. 2017 년 7 월 20 일.
2. Helmenstine, Ph.D. 앤 마리. “동위 원소는 무엇입니까? 정의와 예.” 사고. N.P., N.D. 편물. 여기에서 사용할 수 있습니다. 2017 년 7 월 20 일.
이미지 제공 :
1.” Uwe W.의 Helium-3 및 Helium-4 ″-Commons Wikimedia
2를 통한 자신의 작업 (공개 도메인). "전자 쉘 029 구리"(CC By-SA 2.0 UK) Commons Wikimedia
3. Commons Wikimedia를 통한 "Electron Shell 028 Nickel"(CC By-SA 2.0 UK)