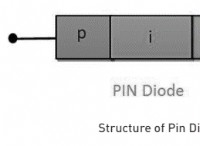
전자는 에너지 증가 순서로 원자 궤도를 채 웁니다.
이는 전자가 먼저 더 높은 에너지 궤도로 이동하기 전에 이용 가능한 가장 낮은 에너지 궤도를 차지한다는 것을 의미합니다. 충전 순서는 (n + l) 규칙 에 의해 결정됩니다. , 어디:
* n 주요 양자 수 (에너지 수준)입니다.
* l 방위각 양자 번호 (서브 쉘 유형, 예를 들어, S, P, D, F)
작동 방식은 다음과 같습니다.
1. 각 궤도에 대해 계산 (n + L). 예를 들어, 2p 궤도의 경우 n =2 및 l =1, so (n + l) =3입니다.
2. (n + L) 값을 증가시켜 궤도를 순서로 정리하십시오.
3. 두 궤도가 동일한 (n + L) 값을 갖는 경우, 낮은 n 값을 가진 궤도가 먼저 채워집니다. .
예 :
* 1s (n + l =1)
* 2s (n + l =2)
* 2p (n + l =3)
* 3s (n + l =3)
* 3p (n + l =4)
* 4s (n + l =4)
* 3d (n + l =4)
* 4p (n + l =5)
* 5s (n + l =5)
* 4d (n + l =5)
* 5p (n + l =6)
* 6s (n + l =6)
* 4f (n + l =6)
중요한 메모 :
* Aufbau 원칙은 전자 구성을 예측하는 데 유용한 지침이지만 항상 완벽한 것은 아닙니다. 전자-전자 반발과 같은 요인과 반으로 채워진 완전히 채워진 서브 쉘의 안정성으로 인한 예외가 있습니다.
* Aufbau 원리는 주로 접지 상태 (가장 낮은 에너지 상태)에서 원자의 전자 구조를 이해하는 데 주로 사용됩니다.
Aufbau 원리를 따르면 전자가 원자 궤도 내에 전자가 어떻게 분포되는지 와이 분포가 원자의 화학적 특성을 결정하는 방법을 이해할 수 있습니다.