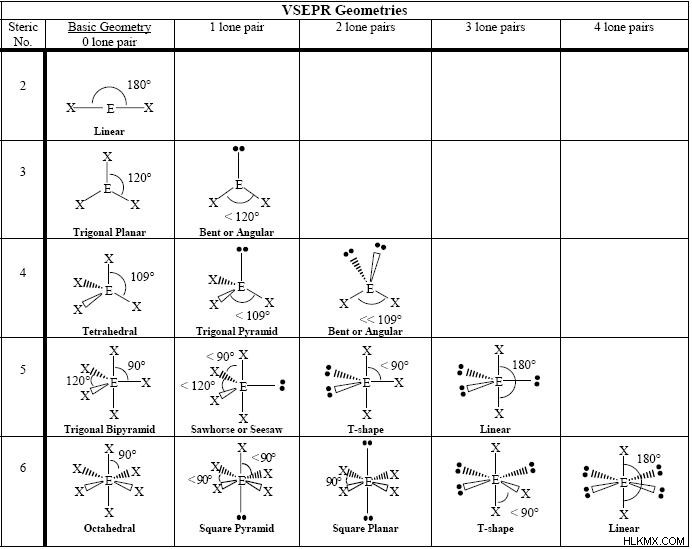
VSEPR 이론은 무엇입니까?
VSEPR 이론은 기하학적 구조를 기반으로 분자를 구성하는 방법 인 원자가 쉘 전자 쌍 반발 이론에 대해 짧다. 화학에서 VSEPR 이론은 분자의 각 원자가 원자가 전자 쌍 사이의 거리를 최대화하여 전자-전자 반발을 최소화하는 지오메트리를 찾는 원리에 기초한다. 원자가 전자는 부정적인 하전이되어 충전을 유발하기 때문에 서로 격퇴합니다.
중앙 원자에 고독한 전자 쌍이없는 분자 이론
단순성과 조직을 위해, 우리는 VSEPR 구조를 두 가지 범주로 분리합니다. 중앙 원자에 고독한 쌍이있는 것과 중앙 원자에 고독한 쌍이없는 것들.
선형
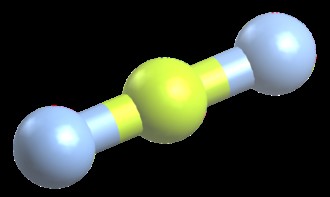
bef 2 선형 분자의 예입니다. bef 2 에는 16 개의 총 원자가 전자가 있습니다. 각 불소 원자에 3 개의 고독한 쌍 (6 개의 전자)을 갖는 분자. 각각의 각 불소 원자상의 이들 고독한 쌍이 다른 불소 원자로부터 가능한 가장 먼 거리가되기 위해, 분자는 직선을 형성한다. 우리는이 모양을 "선형"이라고합니다. 선형 분자의 결합 각은 180도입니다. Co 2 및 beh 2 또한 선형 분자입니다.
삼각 평면
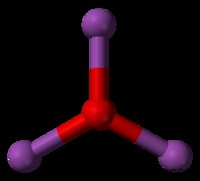
bf 3 삼각 평면 분자의 예입니다. bf 3 에는 24 개의 총 원자가 전자가 있습니다 분자. 각각의 불소 원자가 다른 불소 원자에서 가능한 한 멀리 떨어진 곳에 고독한 쌍을 유지하기 위해, 분자는 삼각형, 2 차원 모양을 형성한다. 분자 형상에서 이것은 "삼각 평면"이라고합니다. 삼각 평면 분자의 결합 각은 120도입니다. Co 3 (탄산염)는 삼각 평면 분자의 또 다른 예입니다.
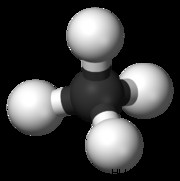
사면체
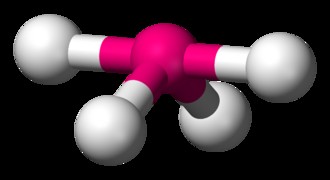
사면체 분자의 일반적인 예는 ch 4 이다 (메탄). 메탄 분자에는 8 개의 총 원자가 전자가 있습니다. 4 개의 하이드로겐이 서로 가장 먼 곳이되기 위해, 우리는 사면체 모양에 도달합니다. 사면체는 정사각형 평면 형상의 3 차원 발현이다. 사면체 분자의 H-C-H 결합 각도는 109.5도입니다.
Trigonal Bipyramidal
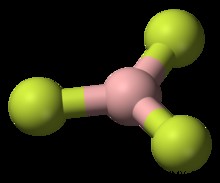
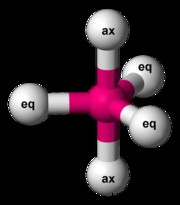
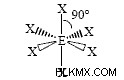
pf 5 삼중 기피라미드 분자의 예입니다. pf 5 총 원자가 전자 38 개가 있습니다. 각각의 P-F 결합은 2 개의 원자가 전자를 사용하고 각 불소 원자에는 3 개의 고독 쌍이있다. 인은 낙지를 확장 할 수 있습니다. 불소 원자 중 3 개는 적도 위치에 있습니다. 다른 두 사람은 축 위치에 있습니다. 적도 불소가 가능한 한 가장 멀리 떨어진 거리가 되려면, P-F 결합은 서로 관련하여 120도 각도이며, 적도와 축 위치 사이의 결합 각도는 90도입니다.
.
팔면체
sf 6 팔면체 분자의 예입니다. sf 6 에는 48 개의 원자가 전자가 있습니다 분자. 각각의 S-F 결합은 2 개의 원자가 전자를 설명하고, 각 불소 원자는 3 개의 고독한 쌍을 운반한다. 유황은 낙지를 확장 할 수 있습니다. 불소 원자들 사이의 반발은 각각을 팔면체의 모서리에 놓아 최소화 될 수있다.
중앙 원자에 고독한 전자 쌍을 가진 분자 이론
구부러진
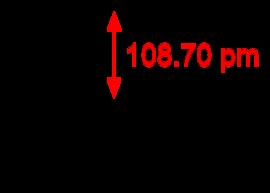
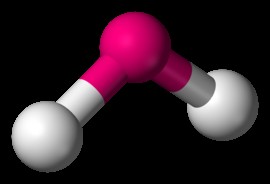
H 2 O는 구부러진 분자의 예입니다. 분자의 중앙 원자가 고독한 쌍을 가질 때,이 고독 쌍은 중앙 원자에 뿌리를 둔 결합을 격퇴시킨다. 물 분자에서, 산소 원자의 고독한 쌍은 수소 결합이 2 차원 공간에서 아래쪽으로 결합된다. 수소 원자 사이의 결합 각은 104도입니다.
삼각 피라미드
nh 3 삼각 피라미드 분자의 예입니다. 암모니아 분자에서, 중심 질소 원자의 고독한 쌍은 전자-전자 반발으로 인해 3 개의 N-H 결합을 아래쪽으로 밀어냅니다.
.
시소
sf 4 시소 모양의 분자의 예입니다. sf 4 에서 분자, 2 개의 S-F 결합은 적도 평면에서 서로 건너 위치에있다. 다른 두 S-F 결합은 3 차원 공간에서 서로 멀어지게됩니다. 이것은 중심 황 원자에 고독한 전자 쌍이 있다는 점을 고려할 때 불소 원자가 서로 가장 큰 거리가 될 수있게한다. 이 고독한 쌍은 Bent 또는 Trigonal Pyramidal Geometries와 마찬가지로 S-F 결합을 밀어냅니다.
T 자형
brf 3 T 자형 분자의 예입니다. brf 3 에서 분자, 브롬 중심 원자에는 2 개의 고독한 쌍이 있으며, 다른 형상보다 Br-F 결합과 더 극단적 인 전자-전자 반발을 강요합니다. 이 모양은 86.2 도의 결합 각도를 진행하며 T 자형 분자에 고유합니다.
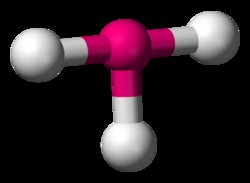
사각형 피라미드
brf 5 에서 분자, 지오메트리는 팔면체 형상을 밀접하게 모방합니다. 유일한 차이점은 제곱 피라미드 형상에서 축 방향 원자 중 하나가 고독한 전자 쌍으로 대체된다는 것입니다.
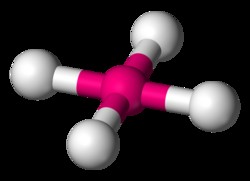
제곱 평면도
제곱 평면 분자 xef 4 에서 , 기하학은 사각형 피라미드의 기하를 밀접하게 모방하지만,이를 위해 축 방향 결합은 다른 고독한 전자 쌍으로 대체되었습니다. 이것은 4 개의 XE-F 결합을 모두 평면, 적도 배열로 밀어 넣습니다.
AX 방법
AX 방법은 분자 형상을 발현하는 대안적인 방법입니다. AX 모델에서 A는 중앙 원자를 나타냅니다. X는 중앙 원자를 나타내고, X는 중앙 원자에 연결된 단일 결합의 수를 나타내고, e는 중앙 원자에 위치한 고독한 전자 쌍의 수를 나타냅니다.
.| AX | 선형 |
| ax | Trigonal 평면 |
| ax 2 e | 구부러진 |
| ax | 팔각형 |
| ax 5 | Bipyramidal |
| ax 4 | 사면체 |
| ax | 피라미드 |
| ax | seesaw |
| ax | T 자형 |
| ax 5 e | 사각형 피라미드 |
| ax 4 e 2 | 사각형 평면 |