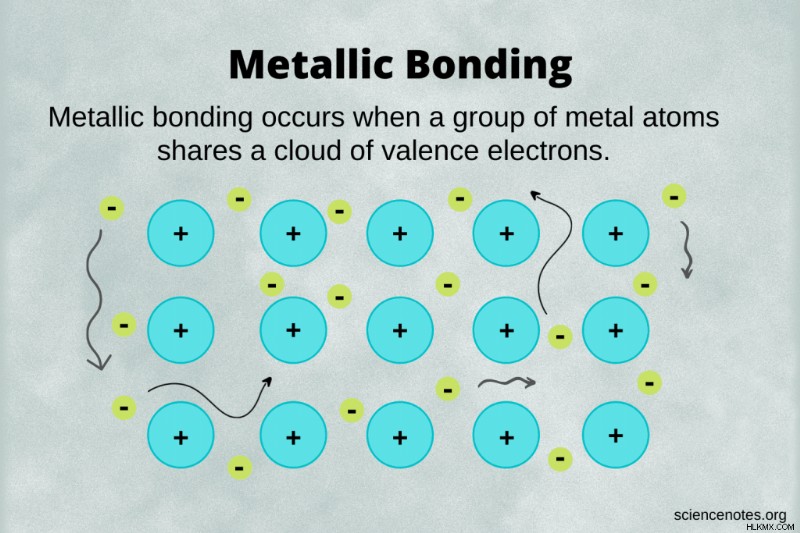
금속 결합 금속 핵이 자유 원자가 전자를 공유하는 화학적 결합의 한 유형입니다. 이 자유 전자는 delocalized 이라고합니다 그것들은 하나의 원자에 제한되지 않았기 때문입니다. 대조적으로, 원자가 전자는 공유 결합에서 두 원자 사이에 공유되며 이온 결합에서 다른 원자 근처에 더 많은 시간을 소비한다.
.- 금속 결합에서, 원자가 전자는 비편정하거나 여러 원자 사이에 자유롭게 흐를 수 있습니다.
- 이온 성 및 공유 결합은 두 개의 원자만을 포함합니다.
- 금속 결합은 금속의 많은 주요 특성을 설명합니다.
전자 바다 모델
전자 바다 모델은 금속 결합에 대한 단순하고 다소 부정확 한 시야이지만 시각화하기가 가장 쉽습니다. 이 모델에서 전자 바다가 금속 양이온의 격자 주위에 떠 다니고 있습니다.
이 모델의 주요 문제는 금속 또는 메탈 로이드 원자가 실제로 이온이 아니라는 것입니다. 예를 들어, 나트륨 금속 덩어리가있는 경우 Na 이온이 아닌 Na 원자로 구성됩니다. 전자는 핵 주위에 무작위로 떠 다니지 않습니다. 오히려, 원자의 전자 구성을 채우는 전자는 해당 원자 또는 이웃 중 하나에서 나옵니다. 어떤 경우에는 전자가 핵 클러스터 주위에 떠 다니고 있습니다. 공유 결합의 공명 구조와 매우 유사합니다.
금속 결합이 형성되는 방법
공유 결합과 마찬가지로, 금속 결합은 유사한 전기 음성 값을 갖는 두 원자 사이에 형성됩니다. 금속 결합을 형성하는 원자는 금속과 일부 금속성입니다. 예를 들어, 금속 결합은은, 금, 황동 및 청동으로 발생합니다. 또한 가압 수소와 탄소 할당 그래프 그래 핀의 결합 유형입니다.
금속 결합 작업을 만드는 것은 양으로 충전 된 핵과 관련된 원자가 전자 궤도가 서로 겹치는 것입니다. 대부분의 경우, 여기에는 s 가 포함됩니다 및 p 궤도. 금속 원자는 양의 핵과 삼각화 된 전자 사이의 인력에 의해 서로 결합됩니다.
금속에 의해 형성된 채권
금속 원자는 비금속과 이온 결합을 형성합니다. 그것들은 자신 또는 다른 금속과 공유 또는 금속 결합을 형성합니다. 수소와 알칼리 금속은 특히 공유 및 금속 결합을 형성합니다. 따라서 금속 수소와 리튬이 발생합니다. h 2 도 마찬가지입니다 및 li 2 가스 분자.
숙제 질문에서 금속 결합
형성된 결합 유형
가장 일반적인 숙제 질문은 두 원자가 금속성, 이온 성 또는 공유 결합을 형성하는지 묻습니다. 원자는 금속이 둘 다 금속 일 때 금속 결합을 형성합니다. 또한 특정 상황에서 공유 결합을 형성 할 수도 있지만 한 가지 유형의 결합을 선택 해야하는 경우 금속성으로 이동하십시오. 이온 성 결합은 매우 다른 전기 음성 값 (일반적으로 금속과 비금속 사이)을 갖는 원자 사이에 형성됩니다. 공유 결합은 일반적으로 두 비금속 사이에 형성됩니다.
특성 예측
금속 결합을 사용하여 금속 요소의 특성을 비교할 수 있습니다. 예를 들어, 금속 결합은 왜 마그네슘이 나트륨보다 융점이 더 높은지 설명합니다. 녹는 점이 더 높은 요소는 더 강한 화학적 결합을 포함합니다.
원자의 전자 구성을 검사하여 더 강한 결합을 형성하는 요소를 결정하십시오.
나트륨 :[ne] 3s
마그네슘 :[ne] 3s
나트륨에는 하나의 원자가 전자가 있고 마그네슘에는 2 개의 원자가 전자가 있습니다. 이들은 금속 결합에서 비편화 된 전자입니다. 따라서 마그네슘 원자 주변의 전자의 "바다"는 나트륨 원자 주변의 바다보다 두 배나 큽니다.
두 원자 모두에서, 원자가 전자는 동일한 수의 전자 쉘 ([NE] 코어 또는 1S 2S 2P)에 의해 스크리닝된다. 각 마그네슘 원자는 나트륨 원자보다 하나의 양성자를 가지므로 마그네슘 핵은 원자가 전자에 더 강한 매력적인 힘을 발휘합니다.
마지막으로, 마그네슘 원자는 핵과 전자 사이에 더 큰 매력적인 힘이 있기 때문에 나트륨 원자보다 약간 작습니다.
이러한 모든 고려 사항을 정리하면 마그네슘이 더 강한 금속 결합을 형성하고 나트륨보다 융점이 더 높습니다.
금속 결합 및 금속 특성
금속 결합은 금속과 관련된 많은 특성을 설명합니다.
- 높은 전기 및 열전도도 :유리 전자는 전기 전도도 및 열 전도도의 열 에너지 (열) 캐리어의 전하 운반입니다.
- 높은 용융 및 끓는 지점 :비편 소화 된 전자와 원자 핵 사이의 강한 매력은 금속이 높은 용융 및 끓는점을 제공합니다.
- 가용성과 연성 :금속 결합은 가용성 및 연성을 포함한 금속 기계적 특성을 설명합니다. 전자는 서로를 지나서 미끄러지기 때문에 금속을 시트로 망치고 (가변성) 와이어로 끌어들일 수 있습니다 (연성)
- 금속 광택 :비편정 전자는 대부분의 빛을 반영하여 금속이 반짝이는 외관을 제공합니다.
- 은색 :대부분의 금속은 대부분의 빛이 진동 공명 전자 (표면 플라즈몬)에서 반사되기 때문에 은은처럼 보입니다. 흡수 된 빛은 가시 범위를 벗어난 스펙트럼의 자외선 부분에있는 경향이 있습니다. 구리와 금에서 흡수 된 빛은 가시 범위 내에있어 이러한 금속이 붉고 황색을 띠게됩니다.
금속 결합은 얼마나 강합니까?
금속 결합은 매우 강한 것에서 약한 것에 이르기까지 다양합니다. 그것의 강도는 주로 전자 껍질이 핵 인력으로 인한 전자 밸런스 전자의 양에 달려 있습니다. 부분적으로 이것은 큰 원자의 상대 론적 영향으로 인한 것이므로, 수은과 란타나이드의 금속 결합은 가벼운 전이 금속보다 약합니다.
금속, 이온 및 공유 결합의 상대적 강도에 대해 일반화하기에는 너무 많은 개별 변화가 있습니다.
참조
- Brewer, Scott H.; Franzen, Stefan (2002). "반사 FTIR 분광법에 의해 결정된 시트 저항 및 표면 애들레이저에 대한 인듐 틴 산화 혈장 주파수 의존성". 물리 화학 저널 B . 106 (50) :12986–12992. doi :10.1021/jp026600x
- Daw, Murray S.; 포일, 스티븐 M.; Baskes, Michael I. (1993). "임베디드 원자 방법 :이론 및 응용에 대한 검토". 재료 과학 보고서 . 9 (7–8) :251–310. doi :10.1016/0920-2307 (93) 90001-U
- Okumura, K. &Templeton, I. M. (1965). “세슘의 페르미 표면”. 런던 왕립 학회의 절차 a . 287 (1408) :89–104. doi :10.1098/rspa.1965.0170
- Pauling, Linus (1960). 화학 결합의 특성 . 코넬 대학 출판부. ISBN 978-0-8014-0333-0.
- Rioux, F. (2001). “H 2 의 공유 결합 ". 화학 교육자 . 6 (5) :288–290. doi :10.1007/s00897010509a