주요 차이 샤페론과 샤페로닌 사이에는 샤페론이 라는 것입니다 공유 접이식 또는 전개 및 다른 거대 분자 구조의 조립 또는 분해를 돕는 단백질 반면 샤페로닌은 분자 샤페론 클래스입니다. 는 변성 단백질의 올바른 폴딩에 유리한 조건을 제공하여 응집을 방지합니다. 또한, 샤페론은 분자량 70-100 kDa를 갖는 단량체이고, 샤페로닌은 800 kDa의 분자량을 가진 올리고머이다.
샤페론과 샤페로닌은 주로 단백질의 폴딩을 담당하는 분자 샤페론 단백질의 두 그룹입니다. 일반적으로 대부분은 열 충격 단백질 (HSP)입니다.
주요 영역을 다루었습니다
1. 샤페론이란 무엇입니까
- 정의, 구조, 기능
2. 샤페로닌이란 무엇입니까
- 정의, 구조, 기능
3. 샤페론과 샤페로닌의 유사점은 무엇입니까
- 일반적인 기능의 개요
4. 샤페론과 샤페로닌의 차이점은 무엇입니까
- 주요 차이점 비교
주요 용어
샤페론, 샤페로닌, 변성 단백질, 열 충격 단백질 (HSP), 단백질 폴딩

chaperones
샤페론은 단백질의 접힘 및 조립을 그들의 고유 구조로 담당하는 분자 샤페론의 한 유형입니다. 또한, 이들은 형태가 잘못된 단백질의 리모델링을 담당한다. 대부분의 샤페론은 열 충격 단백질 (HSP)입니다. 또한 분자량이 70-100 kDa의 단량체입니다. 또한, 샤페론의 세 가족은 HSP70 패밀리, HSP90 가족 및 HSP33 가족입니다.
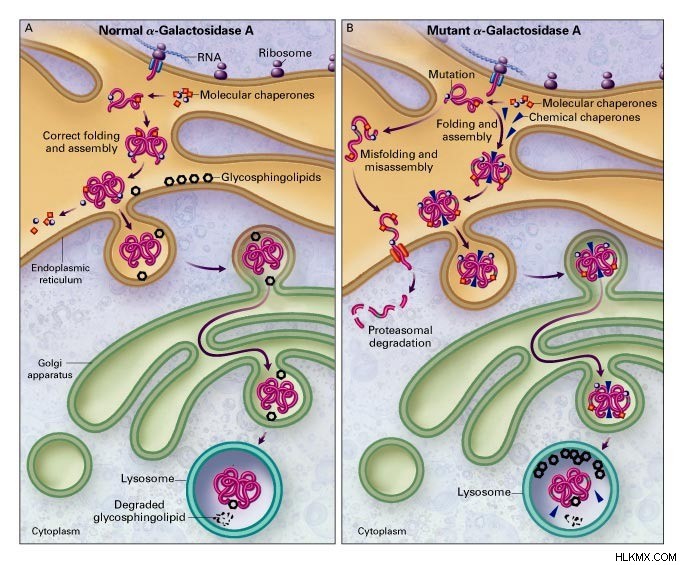
그림 1 :샤페론 함수
HSP70 가족
hsp70 패밀리는 단백질 HSP70으로 구성되며, 이는 분자량이 약 70 kDa입니다. 또한 ATPase 활동을 보여줍니다. 현저하게, 시토 졸에서, DNAK는 박테리아에서 HSP70의 유형이고, 스트레스 유도 성인 HSP72는, 구성적인 HSP73은 더 높은 진핵 생물에서 HSP70의 유형이다. 한편, HSP70은 HSP40 (박테리아의 DNAJ) 및 GRPE와 상호 작용한다. 여기서, HSP40은 ATP의 가수 분해를 자극하는 반면, GRPE는 뉴클레오티드 교환의 요인으로 작용한다.
HSP90 가족
HSP90 가족은 HSP70 가족보다 대표적이지 않습니다. 또한, 세포는 많은 양의 HSP90을 함유하며, 이는 응력 의존적이다. HTPG는 박테리아에서 HSP90 패밀리의 단백질입니다.
HSP33 가족
HSP33 패밀리에는 활성 시스테인과 Zn이 포함되어 있습니다. 합성은 열 충격에 의해 유도되고 산화 적 충격에 의해 활성화된다.
chaperones는 폴더제 또는 홀드 라제 일 수 있습니다. 여기서, 폴드 라 제는 ATP 의존적 방식으로 단백질 폴딩을 지원한다. Poldases의 예로는 Groel/Groes, DNAK, DNAJ 및 GRPE가 포함됩니다. 대조적으로, Holdases는 접합하여 폴딩 중간체의 응집을 방지 할 책임이있다.
샤페로닌
샤페로닌은 다른 유형의 분자 샤페론이며, 특히 변성 단백질의 올바른 폴딩을 돕는다. 샤페로닌의 주요 특징은 모양입니다. 일반적으로, 샤페로닌은 7,8 또는 9 개의 단량체 단위를 갖는 2 링 구조를 갖는다. 따라서, 샤페로닌은 분자량이 800 kDa의 올리고머이다. 반면에, 샤페로닌의 두 가족은 HSP60 가족과 TRIC 가족을 포함합니다.
HSP60 가족
박테리아에서 HSP60 패밀리는 단백질 그릴로 구성되며, 각각의 60kDa의 7 개의 서브 유닛의 2 개의 고리가 있습니다. 또한 ATPase 활성이 있습니다. 또한, 그릴의 보조 인자는 폴리펩티드의 폴딩을 촉진하는 그로스입니다. 한편, 더 높은 진핵 생물에서, HSP60과 그의 보조 인자 HSP10은 HSP60 패밀리의 단백질이다. 이 단백질은 또한 미토콘드리아에서 발생합니다. 그러나, CPN60 및 CPN20이라는 HSP60 패밀리의 단백질은 더 높은 진핵 생물의 엽록체에서 발생한다.
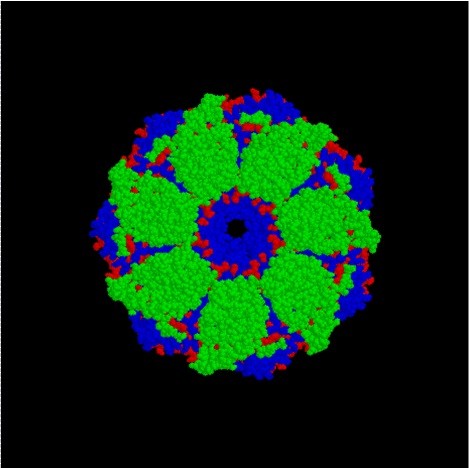
그림 2 :Groel/Groes 단백질 복합체
트릭 패밀리
트릭 패밀리에는 8 개의 서브 유닛의 2 개의 고리가있는 트릭 단백질이 포함되어 있으며 각 크기. 또한, 그것은 박테리아 및 더 높은 진핵 생물의 시토 졸에서 발생합니다.
샤페론과 샤페로닌의 유사성
- 샤페로 닌은 단백질 접힘 및 전개를 돕는 두 그룹의 단백질입니다.
- 단백질의 조립 및 분해를 지원합니다.
- 따라서 그들의 주요 기능은 단백질 항상성을 유지하는 것입니다.
- 이 단백질은 진화에서 고도로 보존됩니다.
- ATPase 활동이 표시됩니다.
- 대부분은 열 충격 단백질 (HSP)입니다.
샤페론과 샤페로닌의 차이
정의
Chaperones는 다른 거대 분자 구조의 공유 폴딩 또는 전개 및 조립 및 분해를 돕는 단백질을 참조하는 반면, 샤페로닌은 변성 단백질의 올바른 폴딩에 대한 유리한 조건을 제공하는 단백질을 참조하여 응집을 방지합니다. 따라서 이것은 샤페론과 샤페로닌의 근본적인 차이입니다.
크기
샤페론은 분자량 70-100 kDa의 단량체이지만, 샤페로닌은 분자량 800 kDa의 올리고머입니다.
모양
대부분의 샤페론은 열 충격 단백질 (HSP)이고 샤페로닌은 배럴을 만들기 위해 서로 위에 쌓인 두 개의 도넛 모양을 가지고 있습니다.
기능
또한, 샤페론과 샤페로닌의 또 다른 차이점은 샤페론이 단백질의 접힘, 전개, 조립 및 분해를 담당하는 반면, 샤페로닌은 거부 된 단백질의 올바른 폴딩을 담당한다는 것입니다.
예제
샤페론에는 DNAK, DNAJ, GRPE, HTPG 및 HSP33이 포함되며 샤페로닌에는 Groel/Groes 및 Tric이 포함됩니다.
결론
간단히 말해서, 샤페론은 단백질의 접이식, 전개, 조립 및 분해를 담당하는 분자 샤페론 단백질 그룹으로, 단백질 구조로 분해합니다. 또한 대부분은 열 충격 단백질입니다. 또한, 이들은 크기가 70-100 kDa의 단량체입니다. 한편, 샤페로닌은 변성 단백질의 올바른 폴딩을 담당하는 다른 유형의 분자 샤페론 단백질이다. 또한, 이것은 단백질 응집을 방지합니다. 샤페로닌은 2 링 구조를 갖는 올리고머이고, 분자량은 800 kDa이다. 따라서 샤페론과 샤페로닌의 주요 차이점은 그들의 구조와 기능입니다.