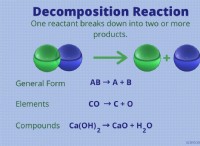
CAO+SO3 =CASO4. 산화 칼슘은 알칼리성 산화물이고, 삼산화 황은 산화 염색화물로, 황산염을 형성 할 수있는 산화물이다. 황화는 실온에서 액체이므로 산화 칼슘과 접촉 할 수 있습니다. 황 삼산화황은 강한 산화제이며 고온에서 황, 인, 철, 아연, 브로마이드, 요오드 라이드 등을 산화시킬 수 있습니다.
황 삼산화질 실험실 준비
황화는 종종 인산을 생성하는 실험실에서 인 펜 독수수와 농축 황산을 공동으로 공동으로 사용하는 데 사용됩니다. 반응에서 생성 된 황화 된 황은 빙수 혼합물로 냉각되어야하고 배기 가스는 농축 황산 (85%)으로 흡수된다.
황 삼산화 황 산업 준비 방법
SO3의 산업 방법은 접촉 방법입니다. 이산화황은 일반적으로 황소 광석 (철광석을 함유하는 황색 광석을 함유하는 황색 광석, 철광석을 함유하는 황색 광석)의 연소에 의해 일반적으로 얻어지며, 먼저 정전기 침전에 의해 정제된다. 정제 된 SO2는 산화 칼륨을 함유 한 바나듐 또는 황산 칼륨 (cocatalyst)을 함유 한 바나듐 펜 옥사이드를 사용하여 400 ~ 600 ℃의 온도에서 산소로 삼산화황으로 산화되어 촉매로서 구조질로서지지된다. 백금은 또한이 반응의 촉매로 작용할 수 있지만 비싸고 혼합물보다 촉매 중독을 유발할 가능성이 높습니다 (고장을 유발). 이러한 방식으로 생성 된 대부분의 황산은 황산으로 전환되지만 물로 흡수 될 수는 없지만, 98.3%의 황산이 흡수성으로 사용되면, 물의 총 증기 압력, 황산의 황산은 가장 낮으며, 흡수 효율은 가장 낮습니다.