가장 반응성이 높은 금속 인 나트륨 이후 알고 있습니까? 아니요? 칼륨입니다! 칼륨은 나트륨, 즉 매우 반응성이 높고 부드럽고 활발한 것과 같습니다. 반응성으로 인해 등유로 유지됩니다. 나트륨과 유사하게, 칼륨은 또한 산소와 반응하여 산화 칼륨을 형성합니다. 그러나 당신은 대답 할 수 있습니다. 산화 칼륨 이온 성입니까, 공유입니까? 이 화합물이 산성입니까, 기본입니까? What are the applications of potassium oxide?
이 섹션에서는 산화 칼륨에 대한 모든 질문을 해결할 수 있습니다.
산화 칼륨이란 무엇입니까?
산화 칼륨은 산소와 칼륨 사이의 결합에 의해 형성된 화합물이다. 산화 디포 사움 또는 일산화 칼륨으로도 알려져 있습니다. 무기 화합물입니다. 산화 나트륨과 마찬가지로, 산화 칼륨은 또한 반응성이 높고 거의 발생하지 않는 화합물입니다.
산화 칼륨이 이온 성인지 또는 공유인지 여부를 쉽게 추측 할 수 있습니다. 첫째, 칼륨은 금속이고, 금속은 전기 양성이며, 산소는 전기 음성 요소 중 하나입니다. 따라서 편광이 발생하고 형성된 화합물은 이온 성입니다.
둘째, 그것은 산화 칼륨 루이스 구조에 의해 설명되며, 더 설명된다.
산화 칼륨의 구조 및 공식
산화 칼륨의 분자 공식은 k₂O입니다. 일반적으로 산화 칼륨을 알칼리 금속 산화물이라고합니다. 그것은 매우 반응성이 높은 칼륨의 가장 간단한 화합물입니다.
이 화합물은 이온 성 화합물입니다. 칼륨은 가장 바깥 쪽 쉘에 전자가 하나만 있고 산소는 2 개의 전자에 부족하기 때문에 성취 된 옥트를 얻습니다. 따라서, 2 개의 칼륨 원자는 전자를 산소 원자에 기증하고 이온 결합을 형성한다. 결과적으로, 화합물 형태는 또한 이온 성이다.
산화 칼륨 루이스 구조는 다음과 같습니다.
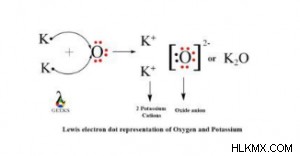
칼륨 이온은 +1 전하를 가지며 산소 이온은 -2 전하를 갖는다. 전기 중립 화합물의 경우, 충전은 서로 균형을 맞추어야합니다. 따라서 O- 원자에서 -2 전하의 균형을 맞추려면 2 개의 K-Atoms가 필요합니다. 결과적으로 산화 칼륨의 공식은 k₂o입니다.
산화 칼륨 제조
산화 칼륨을 준비하는 몇 가지 방법은
입니다1. 과산화 칼륨 칼륨의 도움으로 :
- 수득 된 생성물은 과산화 칼륨, 즉 k₂O₂, 칼륨 금속과 반응하는 산화 칼륨입니다.
k₂o₂ + 2k → 2k₂o
- 500 ℃에서 과산화 칼륨 가열에서, 산화 칼륨 및 산소 분자로 분해된다. .
2K 2O→ → 2K₂O + O₂ ↑
2. 질산 칼륨의 도움으로 :
질산 칼륨이 칼륨 금속으로 처리되면 질소 가스의 방출로 산화 칼륨을 제공합니다. 이 방법은 첫 번째 방법보다 더 유리합니다.
2kno₃ + 10k → 6k₂o + n₂ ↑
3. 수산화 칼륨의 도움으로 :
수산화 칼륨은 산화물로 더 탈수 될 수 없습니다. 그러나 그것은 녹은 칼륨과 반응하여 산화 칼륨을 생산하고 부산물로 수소를 방출 할 수 있습니다.
2koh + 2k ⇌ 2k₂o + h₂ ↑
4. 칼륨 금속의 도움으로 :
칼륨 금속이 산소와 반응하면 산화 칼륨을 제공합니다. 이 반응은
로 표시됩니다4K + O→ → 2K₂O
산화 칼륨의 물리적 특성
칼륨은 나트륨 패밀리의 구성원, 즉 주기율표에서 그룹 I의 구성원입니다. It tends to complete its octet by releasing electrons. 따라서, 그것은 자유 형태로 반응성이 높다. 산소로 처리되면 O- 원자와 쉽게 결합하여 산화 칼륨을 형성합니다. 산화 칼륨의 일부 물리적 특성은 다음과 같습니다.
- 옅은 노란색 또는 흰색의 결정 및 고체 화합물입니다.
- 산화 칼륨 몰 질량은 94.2 g/mol. 입니다
- 비료로 널리 사용됩니다.
- 물보다 밀도가 높습니다. 산화 칼륨의 밀도는 2.35 gm/cm³입니다.
- 그것은 무취 화합물입니다.
- 740 ° C에서 분해
- 에탄올과 디 에틸 에테르에 용해됩니다.
- 산화 칼륨의 열 용량은 83.62 j/mol · k. 입니다
- 산화 칼륨의 분자는 항 플루오 라이트 구조를 형성합니다.
산화 칼륨의 화학적 특성
화합물의 화학적 특성은 화합물의 화학적 조성을 변화시키는 특성이다. 칼륨이 높은 반응성 금속이기 때문에 산화 칼륨은 반응성 화합물이며 격렬하게 반응 할 수 있습니다.
- 과량의 물과 산화 칼륨 반응을 반응하는 것은 강하게 부식성이되고 화합물은 수산화 칼륨을 형성합니다.
k₂o + h₂o → koh
- 금속 산화물이며 일반적으로 금속 산화물은 기본입니다. 따라서 그것은 기본적이거나 알칼리성이며 매우 부식성입니다.
- 산화 칼륨이 강산과 반응하면 소금과 물을 제공합니다. 이 반응은 산화 칼륨이 기본 화합물임을 보여줍니다.
k₂O + HCl → KCl + H₂O
k₂o + h₂so + → k₂so₄ + h₂o
k₂o + hno + → 2kno₃ + h₂o
이러한 반응은 중화 반응의 예입니다.
- 300 ° C 이상 가열되면 산화 칼륨은 과산화 칼륨과 칼륨 금속으로 전환됩니다.
2K₂O → K₂O₂ + 2K
산화 칼륨의 사용 및 적용
그것은 매우 활발하고 수분과 쉽게 반응합니다. 다양한 목적으로 사용됩니다. 그들 중 일부는
입니다- 농업 산업에서 산화 칼륨은 비료로 널리 사용됩니다.
- 그것은 유리 제조 공식과 시멘트 제작 산업에도 사용됩니다.
- 산화 칼륨은 물에 불용성이며 매우 안정적인 화합물입니다. 이 속성은 세라믹 산업에서 편리합니다.
- 동물 관련 질병 치료에 동물 의사가 사용합니다.
- 일반적으로 순수한 칼륨으로 알려져 있으며 안경과 비누를 준비하는 데 사용됩니다.
- 항공 우주 산업에서 산화 칼륨은 구조 화합물과 경량 보울을 제조하는 데 사용됩니다.
- zygomycetes 등과 같은 곰팡이 감염, 산화 칼륨은 이러한 감염을 치료하는 데 사용됩니다.
- 소량의 양은 일부 의약품에 산화 칼륨도 사용됩니다.
산화 칼륨 사용을위한 안전 조치
산화 칼륨은 다양한 목적으로 유용하지만 반응성이 높은 특성은 위험한 화학 물질입니다. 따라서 작업하는 동안 예방 조치를 취해야합니다. 그러나 어떻게 든 산화 칼륨과 접촉하면 즉시 응급 처치를 받아야합니다. 이것들은
입니다1. 눈이 산화 칼륨과 접촉하면
- 즉시 적어도 30 분 동안 많은 양의 물로 눈을 헹구십시오.
- 눈꺼풀을 위아래로 들어 올려 눈을 씻으십시오.
- 눈을 씻는 동안 콘택트 렌즈를 착용 한 경우 제거하십시오.
- Seek medical attention immediately.
2. 피부가 산화 칼륨과 접촉하는 경우 :
- 오염 된 옷을 가능한 빨리 제거하십시오.
- 오염 된 부위가 많은 양의 물로 즉시 씻으십시오.
- 즉시 치료를 받으십시오.
3. 산화 칼륨을 흡입 한 경우 :
- 자신의 장소에서 산화 칼륨에 노출 된 사람을 제거하십시오.
- 호흡이 중단되면 구조 호흡을함으로써 응급 처치를 시작하십시오.
- 그의 마음이 일을 멈췄다면, 심폐 소생술을주십시오.
- 의료 시설로 빠르게 전환하십시오.
결론
위의 기사를 살펴본 후에는 이제 산화 칼륨에 대해 잘 알고 있습니다. 산화 칼륨은 반응성이 높은 특성을 가진 무기산입니다. 산화 칼륨의 공식은 k₂O입니다. 기본 또는 알칼리성 특성이 있습니다. 그것은 강산으로 처리 될 때 중화 반응을 제공합니다. 다른 특성으로 인해 주로 농업의 비료로 사용됩니다. 유리, 세라믹 및 광학 산업에 유용합니다. 섭취하고 흡입하면 독성이 있습니다. 독성 특성으로 인해 작업 중에 예방 조치를 취해야합니다.
자주 묻는 질문
1. 공기에 노출 될 때 칼륨이 몇 가지 유형의 산화물을 형성합니까?
A. 칼륨이 공기 (즉, 산소)에 노출되면 세 가지 유형의 산화물을 형성합니다. 산화물 형성은 반응 동안 산소의 이용 가능성에 따라 다릅니다.
- 산화 칼륨, k₂o
- 과산화 칼륨 칼륨, k₂o₂
- 수퍼 옥사이드 칼륨, 코
반응은
로 발생합니다8k + 4o₂ → 2k₂o + 2ko₂ + k₂o₂
2. 수퍼 옥사이드 칼륨이란 무엇입니까?
A. 수퍼 옥사이드는 화학적 공식 Ko₂를 갖는 무기 화합물입니다. 수퍼 옥사이드 코스 코스에서 산소의 산화 상태는 -1입니다. 촉촉한 공기에서 분해되는 황색의 상자성 고체입니다. 산화 칼륨 또는 과산화 칼륨과 화학적 및 물리적 특성이 다릅니다.
3. 산화 칼륨은 건강 위험을 유발합니까?
A. 산화 칼륨은 화학적 공식 k₂O를 갖는 무기 화합물입니다. 그것은 수분과 공기가 매우 부식성이며 활발합니다. 따라서 화학 반응이나 작업 중에주의와 안전성으로 처리해야합니다. 산화 칼륨으로 인한 일부 건강 위험은
입니다- 피부와 접촉하면 피부 자극을 유발할 수 있습니다.
- 산화 칼륨이 눈에 들어 오면 눈을 심하게 손상시킬 수 있습니다.
- 흡입하면 기침과 호흡 곤란을 유발할 수 있습니다.
- 흡입시 코, 목 및 폐를 자극 할 수 있습니다.
따라서 산화 칼륨으로 실험실에서 일하는 동안 장갑, 실험실 코트 및 안전 안경을 착용해야합니다.
4. 산화 칼륨이 물에 용해되면 형성된 용액의 pH는 무엇입니까?
A. 산화 칼륨은 이온 성 화합물이며 기본적인 특성을 가지고 있습니다. 물에 용해되면 완전히 k⁺ 및 옥 이온으로 분해됩니다. [OH [] 이온의 농도는 용액의 pH를 계산하는 데 사용됩니다.
pH =14 - poh
pH =14 - 1.48 =12.52
따라서 형성된 용액의 pH는 12.52입니다.