크롬의 화합물과 유기 화학에서 가장 인기있는 화학 시약 중 하나 인 칼륨 디 히트로 메이트는 강력한 산화제 역할을합니다. 상업 및 실험실 환경에 산화되는 곳마다 다양한 화학 반응을 가져옵니다. 이 화합물은 약간 부주의조차도 칼륨 디크로 메이트 위험을 초래할 수 있기 때문에 최대한의 관리로 처리됩니다.
칼륨 디크로 메이트 발생
칼륨 디크로 메이트는 자연적으로 로페 자 라이트라고 불리는 희귀 미네랄의 형태로 발생합니다. 그것은 칠레의 아타 카마 사막의 질산염 퇴적물과 남아프리카의 부시 벨트 화성 단지에서 vug 충전물로 얻어집니다.
칼륨 디크로 메이트 공식
디 히 트롬산의 디포 사관 소금입니다. 다음 요소가 포함되어 있습니다.
- 칼륨
- 크롬
- 산소
칼륨 디크로 메이트 공식은 k 2 입니다 cr 2 o 7 . k 2 의 IUPAC 이름 cr 2 o 7 칼륨 디크로 메이트 (vi)입니다. 화합물의 다른 이름은 다음과 같습니다.
- 칼륨 디크로 메이트
- 칼륨 Bichromate
- 칼륨의 Bichromate
- 크롬산, 디포 사체 염
칼륨 디크로 메이트 구조
2 개의 칼륨 양이온과 음으로 하전 된 디 히메이트 음이온을 함유하는 이온 성 화합물입니다. 디 히 트로 메이트는 2 개의 육각형 크롬 원자 (6+ 산화 상태와 함께)를 가지며, 산소 원자에 부착된다.
.
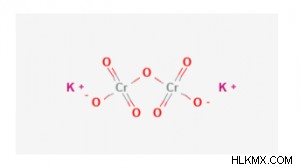
칼륨 디크로 메이트의 구조
그것은 2 개의 칼륨 양이온과 디 히 트로 메이트 음이온 사이에 2 개의 이온 성 결합을 함유한다. 디크로 메이트 음이온은 각각의 크롬 결합이 4 개의 산소 원자에 대한 공유 결합을 갖는다.
칼륨 디크로 메이트의 제조
다음은 디 히 트로 메이트 칼륨의 단계별 준비입니다. 다음 단계와 화학 방정식은이 크로 메이트 칼륨의 형성으로 이어지는 변화를 나타냅니다.
1 단계 : 크롬 철광석 치료 및 나트륨 크로메이트로의 전환
처음에는 광석이 분말 형태로 변환됩니다. 다음으로, 그의 혼합물은 탄산나트륨 및 Quicklime 또는 산화 칼슘으로 제조된다. 이어서, 혼합물을 풍부한 공기 공급을 갖는 잔향 용광로의 고온에서 가열된다. 다음 반응이 발생합니다 :
4 feo.cr 2 o 3 + 8 na 2 Co 3 + 7 o 2 → 8 na 2 cro 4 + 2 fe 2 o 3 + 8 Co 2
2 단계 : na 2 의 변환 cro 4 na 2 에 cr 2 o 7
첫 번째 단계는 나트륨 크로메이트 용액을 제공합니다. 두 번째 단계에서는 산화철 및 불순물을 제거하기 위해 정제되고 여과됩니다.
다음으로, 나트륨 크로메이트는 농축 된 황산과 반응하도록 만들어지며, 이는 나트륨 크로메이트를 디 핵산 나트륨으로 전환합니다.
2 na 2 cro 4 + h 2 그래서
3 단계 : 이 히 트로 메이트 나트륨 및 칼륨 디크로 메이트의 전환
마지막 단계는이 히브로 메이트 나트륨을이 히 트로 메이트로 전환시키는 것입니다. 뜨거운 농축 나트륨 디크로 메이트 용액은 염화 칼륨과 반응하여 원하는 화합물을 제공한다. 반응은 다음과 같이 진행됩니다 :
na 2 cr 2 o 7 + 2 kcl → k 2 cr 2 o 7 + 2 naCl
클로라이드 나트륨과 달리, 칼륨 디크로 메이트는 물에 드물게 용해됩니다. 따라서 용액이 냉각 될 때 결정의 형태로 분리됩니다.
칼륨 디크로 메이트의 특성
이 화합물은 놀랍도록 아름다운 밝은 빨간색 오렌지 색상을 가지고 있습니다. 이온 성 고체 결정 상태에서 발생합니다. 칼륨 디크로 메이트가 화학에 널리 사용되는 주요 이유 중 하나는 비 층위기 때문입니다. 디크로 메이트 나트륨과 같은 다른 소금과 달리 수분 흡수에 쉽게 용해되지 않습니다. 다음은 Dichromate 칼륨의 주요 특성입니다.
- 외관 :적색 오렌지 결정질 고체
- 칼륨 디크로 메이트 몰 질량 :294.185 g/mol
- 냄새 :냄새가없는
- 용융점 :398 ° C (748 ° F; 671 K)
- 밀도 :2.676 g/cm3, 고체
- 끓는점 :500 ° C (932 ° F; 773 K) 분해
- 용해도 :알코올에 불용성, 아세톤
- 물의 용해도 :4.9 g/100 ml (0 ° C)
- 상태 :실온에서 고체.
- 연소 :비전동
- 자연 :부식성이 높습니다.
- 굴절률 :1.738
- 중앙 크롬 원자의 형상 :사면체.
칼륨 디크로 메이트의 화학적 특성
다음은 칼륨 디 콜산이 열, 금속, 알칼리 등과 어떻게 반응하는지 묘사하는 화학 반응 중 일부입니다.
가열에서칼륨 디크로 메이트는 가열 될 때 분해됩니다. 칼륨 크로메이트와 산소를 해방시킵니다. 균형 반응은 변화를 묘사했다 :
4 k 2 cr 2 o 7 → 4 k 2 cro 4 + 2 cr 2 o 3 + 3 o 2
알칼리와의 반응
Alkalis와의 흥미로운 반응이 있습니다. 오렌지색 빨간색 솔루션은 알칼리와 반응하여 노란색으로 변합니다. 노란색은 칼륨 크로메이트의 형성을 나타냅니다. 동일한 수익에 대한 화학 반응은 다음과 같은 수익입니다.
k 2 cr 2 o 7 + 2 KOH → 2 K 2 cro 4 + h 2 o
오렌지색 노란색
또한, k 2 의 노란색 cro 4 k 2 의 형성으로 인해 산성화되면 주황색 빨간색으로 변형 될 수 있습니다. cr 2 o 7 . 다음 반응이 발생합니다 :
2 k 2 cro 4 + h 2 그래서
오렌지색 노란색
산화 반응
- 칼륨 디크로 메이트는 K 2 중 하나로 강력한 산화제입니다. cr 2 o 7 희석 H 2 와 반응하여 3 몰의 산소를 생성합니다. 그래서
4 . 반응은 다음과 같이 요약 될 수있다 :
k 2 cr 2 o 7 + 4 h 2 그래서
- 아래 그림과 같이 ki와 반응 할 때 요오드를 해방시킵니다.
k 2 cr 2 o 7 + 7 H 2 그래서
- 제 2 철 소금은 칼륨 디크로 메이트가 철 염을 산화시킬 때 얻어진다. 이 반응의 균형 방정식은 다음과 같습니다.
k 2 cr 2 o 7 + 7 H 2 그래서
- 그것은 다음과 같이 황화수소로 황화수소를 산화시킨다 :
k 2 cr 2 o 7 + 4 h 2 그래서
염색체 검사
염색체 검사는 클로라이드 함유 염 (염화물 이온)에 대한 인기있는 실험실 테스트입니다. 이 시험에서, 칼륨 디크로 메이트 및 농축 황산은 염화물 염과 반응하여 붉은 갈색 증기의 형태 인 염색체를 제공한다. 반응에 대한 방정식은 다음과 같습니다.
k 2 cr 2 o 7 + 4 kcl + 6 H 2 그래서
칼륨 디크로 메이트의 사용
다음은 Dichromate 칼륨의 기본 용도입니다.
- 칼륨 디크로 메이트는 칼륨 크롬 졸업생 생산에 일반적으로 사용되며 가죽 태닝 산업에서도 사용됩니다.
- 이 화합물은 크롬산을 제조하기위한 원료로 사용됩니다. 크롬산은 유리 제품을 청소하는 데 사용되며 Glassware의 식기 역할을합니다. 그러나 위험한 특성으로 인해 그것의 사용은 매우 제한적이되었습니다.
- 이 화학 화합물은 염료, 카본 블랙, 젤라틴 및 껌 아랍어와 같은 유기 용매의 경화제입니다. 강화 된 용매는 광 기계적 인쇄 공정에서 사용되는 금속 인쇄판 생산에 사용됩니다.
- 건설 산업은 콘크리트 혼합물의 굳은 시간을 증가시켜 밀도와 색상을 향상시켜 시멘트 블록에 사용합니다. 피부에 장기적으로 노출되면 건설 노동자에게 피부병이 발생하지만
- 사진 산업은 칼륨 디크로 메이트를 산화제 및 사진 스크린 인쇄로 사용합니다.
- 사진에서, 희석 h 2 와 함께 칼륨 디크로 메이트 용액. 그래서
4 네거티브 생성에 사용됩니다. - 스크린 인쇄 산업은 또한 빛에 노출시 태닝 피부와 가죽의 특성으로 인해 사용합니다.
- 비수경 특성은 우수한 화학적 시약이되며 주로 에탄올 농도를 결정하는 데 사용됩니다.
- 35% 질산 및 이리 크로 메이트의 용액을 Schwerter의 용액이라고합니다. 은 및 순도와 같은 금속을 분석하는 데 사용됩니다. 이 테스트는 다양한 순도 등급 의은에 대해 다른 색조를 제공합니다.
- 이산화황의 분석적 테스트를 제공하기 위해 칼륨 디크로 네이트 종이가 오렌지에서 녹색으로 바뀝니다.
- 그것은 표면에 광택 마감 처리를 위해 폴리싱 및 태닝 목재에 사용됩니다.
칼륨 디크로 메이트 위험
이 화합물은 매우 유용하지만 엄격한 예방 조치가 필요합니다. 일부 칼륨 디크로 메이트 위험은 다음과 같습니다.
- 그것은 매우 발암 성입니다.
- 연장 된 노출은 호흡기 장기 손상과 사망으로 이어질 수 있습니다.
- 최대 40 그램 이상의 구강 소비는 인체에서 즉각적인 사망 또는 심각한 부작용으로 이어집니다.
- 그것은 부식성이 높고 소비 될 때 내장과 위의 내부 안감을 태우는 경향이 있습니다.
- 가벼운 노출조차도 과도한 배뇨, 구토 및 느슨한 움직임과 같은 증상을 유발할 수 있습니다.
- 이 히크로 메이트 칼륨의 칼륨은 심장 질환으로 이어질 수 있으며 저혈압, 심장 마비, 심장 마비 오작동, 혈액 정맥 질어 및 기타 합병증을 초래할 수 있습니다.
- 피부 화상은 칼륨 디크로 메이트를 사용하는 실험실에서 흔한 문제입니다.
- 또한 심한 눈 손상이나 실명을 유발할 수 있습니다.
- 장기간 노출은 생식 질환, 태아에게 해를 끼치고 남성의 생식력 상실 및 기타 유전 적 장애로 이어질 수 있습니다.
결론
칼륨 디크로 메이트는 산화제로서 실험실에서 널리 사용되는 무취의 적색 오렌지색 화합물이다. 클로라이드 이온을 분석하는 데 사용되는 유명한 염색체 검사의 일부입니다. 그러나 부식성 특성으로 인해 경미한 노출조차 심각한 위험을 초래할 수 있기 때문에 시약을 사용하는 동안주의해야합니다.
자주 묻는 질문
1. 코타슘 디크로 메이트를 만지면 어떻게됩니까?
A. 칼륨 디크로 메이트와의 접촉은 피부 화상, 발적 및 통증을 유발할 수 있습니다. 눈과 접촉하면 각막 부상이나 실명과 같은 심각한 문제가 발생할 수 있습니다.
2. 도이 크로 메이트 칼륨을 어떻게 중화시킬 것인가?
A. 칼륨 디크로 메이트 유출의 경우, 나트륨 대사 산 나트륨 또는 바이 설 파이트를 사용하여 중화 될 수 있습니다.
.3. 칼륨 디크로 메이트를 좋은 산화제로 만드는 이유는 무엇입니까?
A. 이리 크로메이트는 우수한 산화제입니다. 산화 특성은 산성 매체에서 향상됩니다.