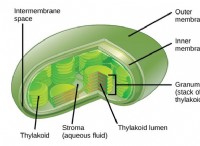
두더지는 화학에서 가장 중요한 개념 중 하나입니다. 기술적 인 용어로 두더지는 물질의 6.022 x 10 분자로 구성됩니다. 보다 실용적인 용어로, 두더지는 원자 질량 단위 또는 AMU의 물질의 분자량과 동일한 그램의 물질량을 갖는 데 필요한 분자의 수입니다. 따라서, 물질의 분자량이 1 몰에 필요한 그램의 수를 나타내는 경우, 주어진 양의 물질로 표현되는 두더지의 수는 해당 물질의 그램을 분자량으로 나눈 값과 같다. 수학적으로 이것은 Moles =Grams ÷ 분자량 또는 Moles =g ÷ mw.
로 표시됩니다.- 요소의 주기성 테이블
- 계산기
두더지가 계산되는 화합물의 분자식을 결정하십시오. 이 정보가 아직 사용할 수없는 경우, National Institute of Standards and Technology 웹 사이트를 포함하여 수많은 참조 서적과 온라인 데이터베이스가 리소스 섹션에 제공하는이 정보를 제공합니다. 예를 들어, 250 mg 아스피린 정제에서 아스피린의 두더지를 결정하고 싶다고 가정 해 봅시다. NIST 데이터베이스에 "아스피린"을 입력하면 약물의 화학적 이름이 2- 아세틸 옥시-벤조산이고 그 분자 공식은 C9H8O4임을 보여줍니다. 이것은 하나의 아스피린 분자가 9 개의 탄소 원자, 8 개의 수소 원자 및 4 개의 산소 원자를 함유 함을 나타냅니다.
원소의 주기율표에 제공된 원자량을 사용하여 화합물의 분자량을 계산하십시오. 각 유형의 원자 수에 분자량을 곱한 다음 제품을 합산하십시오. 아스피린의 경우, 탄소, 수소 및 산소의 분자량은 각각 12.01, 1.01 및 16.00 amu입니다. 따라서 아스피린의 분자량은 9 (12.01) + 8 (1.01) + 4 (16.00) =180.17 amu.
입니다.그램의 물질을 AMU의 분자량으로 나누어 물질의 두부를 계산하십시오. 이 경우, 아스피린 정제는 250 mg 또는 0.250 g을 함유한다. 따라서, 0.250 g ÷ 180.17 amu =0.00139 몰의 아스피린.