핵심 개념
이 튜토리얼에서는 쌍극자 모멘트에 대해 모두 배우게됩니다 . 먼저, 우리는 화학 결합 및 분자에서 쌍극자 모멘트의 존재에 대한 기본 소개로 시작합니다. 그런 다음 쌍극자 모멘트를 계산하는 데 사용되는 공식에 대해 논의하고 스칼라가 아닌 벡터로 분류를 설명합니다. 마지막으로, 우리는 순 쌍극자 모멘트를 결정할 때 분자 기하학의 중요성을 보여주는 몇 가지 예를 제공합니다.
다른 기사에서 다루는 주제
- 전자 궤도 및 궤도 형태
- 전자 친화력이란 무엇입니까?
- 시그마와 PI 본드
- 공식 요금이란 무엇입니까? 양이온 및 음이온
쌍극자 순간 소개
쌍극자 모멘트는 양성 및 음의 전하가 분리되는 모든 시스템에서 발생합니다. 따라서, 그것들은 이온 성 및 공유 결합에서 찾을 수 있습니다. 쌍극자 모멘트는 불평등 한 전자 분포의 결과이며, 이는 화학적으로 결합 된 원자 사이의 전기 음성화의 차이로 인해 발생합니다 (전자는보다 전기 음성 원자로 이동하는 경향이 있기 때문에). 전기 음성의 차이가 커지면 결과적으로 더 큰 쌍극자 모멘트가 생길 것입니다.
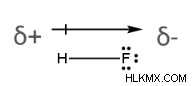
그것들은 크기와 방향을 모두 갖기 때문에 쌍극자 모멘트는 벡터 수량으로 간주됩니다. 아래는 하이드로 플루오르 산 분자에 존재하는 쌍극자 모멘트의 예입니다. 화살표는 분자에서 전자 밀도의 이동을 나타낸다; 그것은 덜 전기 음성 (그리고 더 양성으로) 수소 원자와 더 전기 음성 (그리고 더 음전적인) 불소 원자를 향해 지적한다.
.
결합 쌍극자 모멘트와 분자 쌍극자 모멘트의 차이점에 주목하는 것이 중요합니다. 결합 쌍극자 모멘트는 분자에서 두 원자 사이의 화학적 결합의 극성의 측정이다. 한편, 분자 쌍극자 모멘트 (순 쌍극자 모멘트라고도 함)는 분자의 극성의 측정치이다. 따라서, 다 원소 분자 (즉, 3 개 이상의 원자로 구성된 분자)에서, 순 쌍극자 모멘트는 분자에 존재하는 모든 결합 쌍극자 모멘트의 벡터 합이다. 또한 순 쌍극자 모멘트는 VSEPR 이론을 사용하여 예측할 수있는 분자의 기하학에 영향을받습니다.
쌍극자 모멘트 공식
화학 결합의 쌍극자 모멘트를 계산하려면 다음 공식이 사용됩니다. µ =QR (여기서 µ는 본드 쌍극자 모멘트이고, Q는 분리 된 전하의 크기이고, R은 전하 사이의 분리 거리입니다). 쌍극자 모멘트를위한 SI 단위는 쿨롱 미터 (C-M)입니다. 그러나 Debyes (D)에서 가장 일반적으로 측정됩니다. 1 Debye는 3.336 x 10coulomb-meters입니다.
위에서 언급 한 바와 같이, 쌍극자 모멘트는 크기 (전기 음성 차이에 의해 결정됨)와 방향 (보다 전기 음성 원자를 향한 전자의 움직임에 기초 함)을 갖기 때문에 벡터 수량이다. 따라서, 대칭 분자가 서로를 취소하는 개별 결합 쌍극자 모멘트 (크기는 동일하지만 방향의 반대)를 가질 때 분자의 순 쌍극자 모멘트가 0이 될 수있다. 이 경우, 분자는 다수의 극성 결합을 포함한다는 사실에도 불구하고 비극성으로 분류 될 것이다.
쌍극자 모멘트 예제
CO 2 쌍극자 모멘트
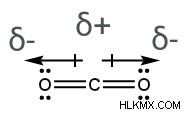
이산화탄소 분자에서 (Co 2 ), 두 개의 극성 공유 결합이있다; 각각은 중심 탄소 원자와 부착 된 산소 원자를 포함한다. 산소는 탄소보다 전기 음성이기 때문에, 두 산소 원자는 부분 음성 전하를 갖는 반면, 탄소 원자는 부분 양성 전하를 갖는다. 분자의 결합 쌍극자 모멘트를 나타내는 두 화살표는 결과적으로 탄소 원자에서 산소 원자를 향해 지적합니다. 또한, 중심 원자는 2 개의 다른 원자와 결합하고 전자의 고독한 쌍이 부족하기 때문에 Co 2 선형 구조 (결합 각인 180 °)가 있습니다. 따라서, 두 개의 본드 쌍극자 모멘트는 반대 방향으로 실행되며 서로를 취소합니다. 이것은 co 2 을 의미합니다 순 쌍극자 모멘트는 0이고 비극성 분자입니다.
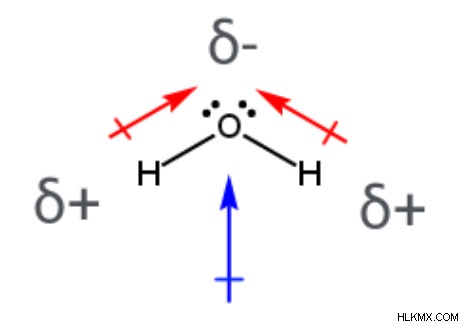
H 2 o 쌍극자 모멘트
물 분자에서 (H 2 o), 두 개의 극성 공유 결합이있다; 각각은 중심 산소 원자와 부착 된 수소 원자를 포함한다. 분자의 결합 쌍극자 모멘트를 나타내는 두 화살표는 덜 전기 음성 수소 원자에서 멀어지고 전기 음성 산소 원자를 향해 지적합니다. 또한, 산소 원자는 부분 음전 전하를 갖는 반면, 두 수소 원자는 부분적으로 양성 전하를 갖는다. 중심 산소 원자는 2 개의 다른 원자와 결합하고 2 개의 고독한 전자 쌍을 함유하기 때문에 H 2 의 구조. O는 구부러져 있습니다 (결합 각인 104.5 °). 이산화탄소 분자와는 달리, 물 분자의 개별 결합 쌍극자 모멘트는 취소되지 않습니다. 이것은 h 2 을 의미합니다 o 순 쌍극자 모멘트가 있고 극성 분자입니다.
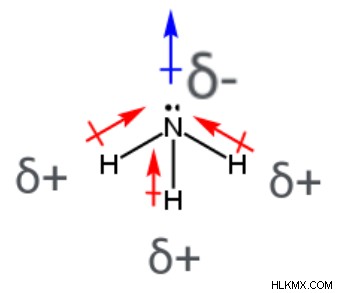
nh 3 쌍극자 모멘트
암모니아 분자에서 (NH <서브> 3 ), 3 개의 극성 공유 결합이있다; 각각은 중심 질소 원자와 부착 된 수소 원자를 포함한다. 전자는보다 전기 음성 질소 원자를 향해 이동하고 덜 전기 음성 수소 원자 (3 개의 개별 결합 쌍극자 모멘트에 대한 화살표에 의해 표시됨)로부터 멀리 떨어진 경향이있다. 질소 원자는 부분 음전 전하를 갖는 반면, 수소 원자는 부분적으로 양성 전하를 갖는다. 중심 질소 원자는 3 개의 다른 원자와 결합하고 하나의 고독한 전자 쌍을 갖기 때문에, 암모니아 분자는 삼중-피라미드 형태 (결합 각인 107 °)를 갖는다. 암모니아 분자의 개별 결합 쌍극자 모멘트는 취소되지 않습니다. 이것은 nh 3 를 의미합니다 순 쌍극자 모멘트가 있고 극성 분자입니다.
추가 읽기
- 극성 대 비극성 결합 및 분자
- 원자가 본드 이론
- 루이스 도트 구조
- 공명 구조