Avogadro의 법률 핵심 개념
이 기사에서는 두더지의 양이 부피와 어떤 관련이 있는지, Avogadro의 법칙을 사용하여 부피 관계를 결정하는 방법을 배우게됩니다.
다른 기사에서 다루는 주제
- 압력이란?
- Dalton의 부분 압력법
- 찰스 법률
- 보일 법
- 이상적인 가스 법률
- van der Waal의 국가 방정식
- 운동 분자 이론
- 결합 된 가스 법률
고려해야 할 중요한 것들
이 기사에 설명 된 가스 법률은 이상적인 가스에만 적용되며,이 기사에서 읽을 수 있습니다. 이상적인 가스 법률 .
압력 및 두더지
1 몰의 산소로 채워진 피스톤을 고려하십시오. 피스톤의 압력은 1 atm입니다. 우리가 우리의 기사 에서 알듯이 압력이란 무엇입니까 , 가스의 압력은 벽과의 가스 입자의 충돌 합계에 의존합니다.
이제 탱크에 다른 두더지의 산소를 추가하면 어떻게 될지 고려하십시오. 이제 입자의 양이 두 배가되어 충돌의 합도 두 배가됩니다.
충돌량의 두 배에서 힘은 두 배가되어 압력이 두 배로 증가했습니다. 피스톤은 압력을 동등하게하기 위해 부피를 바꿀 수 있기 때문에 보일의 법칙에 따라 피스톤이 확장되고 양이 증가합니다.
이것으로부터, 우리는 두더지와 부피 사이의 관계를 볼 수 있습니다.
Avogadro의 법률 관계
Avogadro의 법칙은이 관계를 설명하며,이 관계는 두더지의 양과 부피가 비례한다는 것을 나타냅니다. 이것은 방정식으로 설명 할 수 있습니다.  .
.
Boyle의 법칙에서 우리는 그것을 알고 있습니다 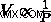 . 이 관계에서 우리는 Avogadro의 법칙을 다시 쓸 수 있습니다
. 이 관계에서 우리는 Avogadro의 법칙을 다시 쓸 수 있습니다 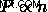 .
.
일정한 온도 관계
두더지의 양은 부피에 비례하고 용기에있는 가스의 두더지의 양은 가스의 동일성에 의존하지 않기 때문에 일정량의 두더지의 부피는 항상 주어진 온도와 압력에 대해 동일합니다.
표준 조건에서 이상적인 가스의 경우이 부피는 22.4 L입니다. 이는 1 atm 및 273 섭씨 1 몰의 가스가 22.4 L을 차지할 것임을 의미합니다.
Avogadro의 법률 예제 문제
다음은 Avogadro의 법칙을 사용하여 문제를 해결하는 방법의 예입니다.
날씨 풍선은 25 몰의 헬륨 가스로 채워졌으며 600 L의 부피를 차지했습니다. 풍선은 과도하게 늘어 났으며, 따라서 기상 엔지니어는 헬륨 가스를 꺼내기로 결정했습니다. 날씨 풍선의 표준 크기는 521 L입니다. 풍선의 양을 안전한 크기로 줄이려면 몇 몰의 헬륨을 제거해야합니까?
해결책 :
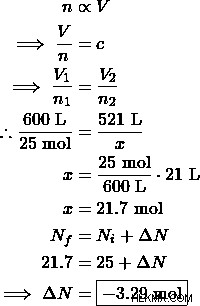
따라서 엔지니어는 3.29 몰의 헬륨 가스를 꺼내야합니다.