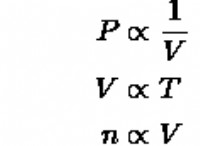화학 결합에 관한 중요한 이론
화학 결합의 개념을 이해하는 것은 화학의 주제를 연구 할 때 가장 기본적이고 중요한 지식으로 간주됩니다. 이 기사에서는 화학적 결합에 관한 몇 가지 중요한 이론에 대해 논의 할 것입니다.
원자가 본드 이론
과학적으로 화학 결합/분자 형성을 설명하기 위해 원자가 결합 이론이 제안되었다. 원자 궤도와 원자의 전자 구성을 기반으로합니다. "모든 분자의 전자는 하이브리드 화 과정에 의해 분자 궤도 대신 원자 궤도를 점유하려고 시도한다"고 말합니다. 형성된 화학적 결합의 결합 강도는 겹침에 의존한다; 중첩이 클수록 분자의 결합 강도가 강해집니다.
다음은 두 가지 유형의 중첩 궤도입니다.
시그마
- 내부 핵 축 주위의 겹치는 것을 축 방향 겹치라고합니다. 예 :C-H 결합 또는 C-X 결합.
- 엔드 투 엔드 오버랩이 발생합니다.
- 한 머리는 다른 겹치기
pi
- 이것은 두 가지 비 뇌화 궤도의 측면 겹치는 것입니다. 예 :C =O 채권.
- 핵 축에 수직으로 겹치십시오.
- 측면 중첩.
VSEPR 이론
VSEPR 이론으로 더 잘 알려진 원자가 쉘 전자 쌍 반발 이론은 화학에서 분자의 구조적 기하학을 예측하는 데 사용되는 분자 구조 모델 중 하나입니다. 이것은 중앙 원자를 세우고 중앙 원자를 부착하고 균형 잡힌 상태를 달성하는 데 도움이되는 단일 전자 쌍으로 주변을 둘러싸고 있습니다.
.강한 결합이 생성되는 동안, 이는 전자-전자 반발이라고 불리는 현상이 발생하며, 이는 형성된 분자의 원자가 전자에서 동일한 전하 반발로 인해 발생한다. 이것은 전형적으로 원자들 사이에 독특한 기하학적 배열을 초래하며, 이는 형성된 분자의 전체 에너지를 감소시킨다. 분자의 기하학은 원자가 전자의 반발을 책임지기 때문에 분자 구조의 고독 쌍의 수에 따라 다릅니다.
.다음은 분자에서 전자 그룹의 수와 고독한 전자 쌍에 따른 일부 형상입니다.
| 전자 그룹의 수 | 전자의 고독한 쌍의 수 | 후속 기하학 | 본드 각도 |
| 2 | 0 | 선형 | 180 ° |
| 3 | 0 | 삼각 행성 | 120 ° |
| 1 | 구부러진 | <120 ° | |
| 4 | 0 | 사면체 | 109.5 ° |
| 1 | 삼각 피라미드 | 107 ° | |
| 2 | 구부러진 | 105 ° | |
| 5 | 0 | 삼각형 Bipyramidal | 90 °, 120 ° |
| 1 | SEE-SAW | <90 °, <120 ° | |
| 2 | t- 구조 | <90 ° | |
| 3 | 선형 | 180 ° | |
| 6 | 0 | 팔면체 | 90 °, 90 ° |
| 1 | 사각형 피라미드 | 90 °, <90 ° | |
| 2 | 정사각형 행성 | 90 ° |