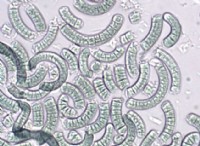
동일한 물리적 상태에서 수많은 다른 형태로 존재하는 화학적 요소의 특성은 동종 영역 또는 동종 분열로 알려져 있습니다. 이러한 형태는 요소의 동반 로프라고도합니다. 유황은 원자 질량 40 및 원자 번호 16을 갖는 비 메탈로, 그룹 16의 칼코겐 패밀리 및 현대 장거리 형태주기 테이블의 기간 3에 속한다. 유황 동종 트로프에는 여러 가지 유형이 있습니다. 모든 동종 트로프는 두 그룹, 즉 공 결정물 및 비정질 형태로 나뉩니다. 결정질 형태는 더 이상적인 정열 및 단일 클린 형태로 나뉩니다. 비정질 형태는 세 가지 형태로 더 나뉘어져 있습니다 - 플라스틱, 콜로이드 및 황유 우유
황의 동종에서, 황색 마름모꼴 및 모노 클리닉 형태가 가장 중요합니다. 이 형태는 특별한 조건 하에서 서로 교환 할 수 있습니다. 지난 세기에,이 동화물은 진주 황의 어머니, Muthmann의 황 1, Engel 's Sulfur 등과 같은 전통적인 이름을 부여 받았다. 황화 동 만화의 수는 결합 해리 에너지의 강한 s - s 결합의 상대적 안정성을 반영한다. 265 kj/mol.
마름모꼴 황화
일반적으로 명명 - 황,이 할당은 노란색이며 용융점은 385.8k이고 비중 2.06입니다. 그것의 결정은 CS₂에서 롤 황 용액을 증발시킴으로써 형성된다. 이것은 극성 용액이 아니기 때문에 물에 불용성이지만 벤젠 알코올에 약간 용해되어 CS₂에 빠르게 용해됩니다. 일반적으로‘유황의 꽃’또는 "황의 롤"으로 알려져 있습니다. 그것은 일반 온도에서 가장 열역학적 안정 형태의 황입니다. 크라운과 같은 S8 포적 링 구조가 있습니다.
모노 클리닉 황
일반적으로 유황으로 알려진 단일 클리닉 황은 프리즘 유황 및 무스만의 유황 II와 같은 다양한 일반적인 이름을 가지고 있습니다. 또한 S8 Puckered 고리를 포함하는 노란색 고체입니다. 95.3 ° C 이상으로 안정됩니다. 녹는 점은 393k이고 비중은 1.98입니다. CS₂에도 용해됩니다. 이 황 할당은 용기에 마름모꼴 설페이트를 녹여 빵 껍질이 형성 될 때까지 냉각시킴으로써 제조된다. 크러스트에 두 개의 구멍이 만들어지고 나머지 액체는 배수됩니다. 빵 껍질이 제거되면 황색의 황색 바늘의 결정. 그것은 369k 이상으로 안정적이며 그 아래의 황으로 변환됩니다. 대조적으로, - 황은 369k 미만으로 안정적이며 그 위의 황으로 변환됩니다. 369K에서 두 형태는 안정적입니다. 369k의 온도는 황 동화 로프의 교대 온도로 알려져 있습니다.
플라스틱 황
플라스틱 황은 비정질 유형의 황입니다. 그러나 열은 무한정으로 무정부 상태로 남아 있지만 실온에서는 몇 시간 안에 빛나며 외부에서 내부로 결정화 (셀레늄과 같은)를 계속합니다.
황의 우유
황의 우유는 칼슘의 황산염을 함유하는 침전 된 황화 황산염이라고 불리는 비정질 흰 고체입니다. 일반적으로, 이는 염산 대신 황산을 사용하여 얻은 침전물로 구성됩니다. 순수한 황에서 침전 될 때, 유황 우유라고합니다. 그것은 우리가 가열 할 때 다양한 피부 장애의 치료에 사용되며, 기존의 황색의 황으로 변합니다. 에테르, 알코올 등과 같은 비극성 용매에 용해됩니다.
콜로이드 황
콜로이드 황은 특수 처리를 통해 얻은 비정질 유형의 황입니다. 작은 황의 작은 입자가 매달려 물에 쉽게 용해되어 콜로이드 혼합물을 형성 할 때 준비됩니다. 금속성 물질의 콜로이드 용액 생산에 일반적으로 사용되는 최상의 음극 분쇄 방법도 성공적으로 확장되었습니다. 콜로이드 황의 사용은 수컷 산의 푸마르 산으로의 전환을 가속화합니다.
디 설 푸르
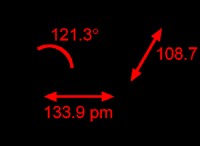
디황 푸르는 주로 530 ℃에서 720 ℃에서 720 ℃ 이상의 유황 증기의 형태이다. S -S 결합 길이는 188.7 pm입니다. 그것은 S2 분자에 의한 빛의 방출에서 그것을 태우고 불꽃을 생성하기 때문에 푸른 색입니다. 공식은 S2입니다. 분자는 결정 학적 측정을 위해 화합물 [S2I4] [EF6] 2 (E =AS, SB)에 갇히게되며, 이산화탄소에서 과량의 요오드로 원소 황을 처리함으로써 생성된다. [S2I4] 2+ 양이온은 각각의 [i2]+양이온이 쌍을 이루지 않은 전자를 π* 분자 궤도에서 S2 분자의 빈 궤도에 기증한다는 점에서 "오픈 북"구조를 갖는다. 그것은 본질적으로 상자성입니다.
hexasulfur
이 동반 로프는 1891 년 M.R. Engel에 의해 HCl로 티오 설페이트를 치료함으로써 처음 준비 하였다. 그것은 주황색-빨간색의 동반 로프이며 rombohedral 결정 형태를 형성합니다. 일반적으로 ρ-sulphur, ε-sulphur, Engel 's Sulfur 및 Aten의 황이라고합니다. 대안적인 제조 방법은 폴리 설폰의 황과 단색화물 반응을 포함한다. 폐쇄 링 구조입니다. 사이클로 -S6의 황 고리는 사이클로 헥산의 의자 형태와 유사한 "의자"형태를 하였다. 모든 황 원자는 205.7pm의 결합 길이와 102.2 도의 결합 각도와 동일합니다.
결론
황의 각각의 동반은 다른 물리적 특성을 가지며 상호 전환 가능하다. 마름모꼴 황은 369k 이상으로 가열 될 때 단일 클리닉 황으로 전환됩니다. 모노 클리닉 황은 369k 미만의 마름모로 변환됩니다. 6-20 개의 황 원자를 함유하는 황의 다른 많은 변형은 지난 20 년 동안 합성되었습니다.