주요 차이 - 추가 대 치환 반응
추가 반응, 대체 반응 및 제거 반응은 유기 화학에서 근본적인 반응입니다. 대부분의 화학적 합성 및 식별은 이러한 반응에 기초합니다. 이러한 반응은 한 단계 또는 두 단계에서 발생할 수 있습니다. 첨가와 치환 반응의 주요 차이점은 첨가 반응은 둘 이상의 원자 또는 기능 그룹의 조합을 포함한다는 것입니다 치환 반응은 다른 기능 그룹에 의한 원자 또는 기능 그룹의 변위를 포함한다.
주요 영역을 다루었습니다
1. 추가 반응
- 정의, 분류, 특성, 예
2. 대체 반응이란 무엇인가
- 정의, 분류, 특성, 예
3. 첨가와 대체 반응의 차이점은 무엇입니까
- 주요 차이점 비교
핵심 용어 :첨가 반응, 부가 물, 시클로 조정, 전기성, 전자 성 첨가, 전자 성 치환, 자유 라디칼 첨가, 퇴치 그룹, 비극성 첨가 반응, 친 핵성, 친 핵성 첨가, 친 핵성 치환, 극성 첨가 반응, 급진적 치환, 치환, 기질
추가 반응
첨가 반응은 큰 분자를 형성하기 위해 둘 이상의 원자 또는 분자의 조합입니다. 이 큰 분자는 부가 물 로 알려져 있습니다 . 대부분의 첨가 반응은 이중 결합 또는 삼중 결합을 갖는 불포화가있는 분자로 제한됩니다. 이러한 추가 반응은 다음과 같이 분류 될 수 있습니다.
추가 반응 분류
- 극성 첨가 반응
- elecropholic addite
- 친 핵성 첨가
- 비극성 첨가 반응
- 자유 라디칼 추가
- 사이클로 addition
전자 성 첨가
elecropholic 첨가는 전기와 분자와의 조합입니다. 전기성은 전자가 풍부한 종으로부터 전자 쌍을 수용하고 공유 결합을 형성 할 수있는 원자 또는 분자이다. 더 많은 전자를 수용하기 위해, 전기성은 긍정적으로 하전되거나 중립적이며 들어오는 전자에 대한 자유 궤도가 있습니다. 부산물은 첨가 반응으로부터 제공되지 않습니다.
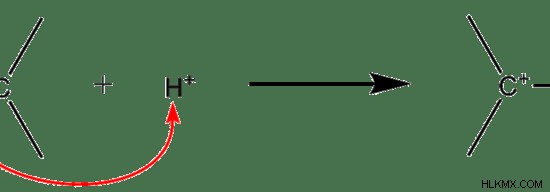
그림 01 :전자 첨가
위의 예에서 h는 electrophile 역할을합니다. 그것은 긍정적으로 청구됩니다. 이중 결합의 pi- 결합에는 전자가 풍부합니다. 따라서, electrophile (h)는 이중 결합을 공격하고 전자를 얻기 위해 전자를 얻습니다. 상기 예에서, 새로 형성된 분자는 다시 전기성이다. 따라서 전자 성 첨가 반응을 겪을 수도 있습니다.
친 핵성 첨가
친 핵성 첨가는 분자와의 친핵체의 조합입니다. 친핵체는 전자 쌍을 기증 할 수있는 원자 또는 분자이다. 친핵체는 전기를 전기성에 기증 할 수있다. PI 결합, 원자 또는 자유 전자 쌍을 갖는 분자를 갖는 분자는 친추실로 작용한다.
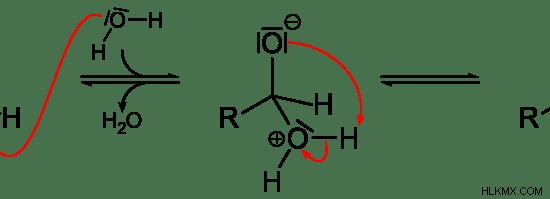
그림 02 :친 핵성 첨가
위의 이미지에서“h 2 o“친핵체이며 산소 원자에 고독한 전자 쌍이 있습니다. c 원자가 –c =o 결합의 극성으로 인해 부분 양전하가 있기 때문에 중심 탄소 원자에 부착 될 수 있습니다.
.자유 라디칼 첨가
자유 라디칼 추가는 두 급진적 또는 급진적과 비-라디칼 사이에 발생할 수 있습니다. 그러나 자유 라디칼 첨가는 세 단계를 통해 발생합니다 :
- 개시 - 라디칼 형성
- 전파-라디칼은 새로운 라디칼을 형성하기 위해 비 라디칼과 반응합니다
- 종료 - 두 개의 급진파가 결합되고 새로운 라디칼의 형성이 종료되었습니다
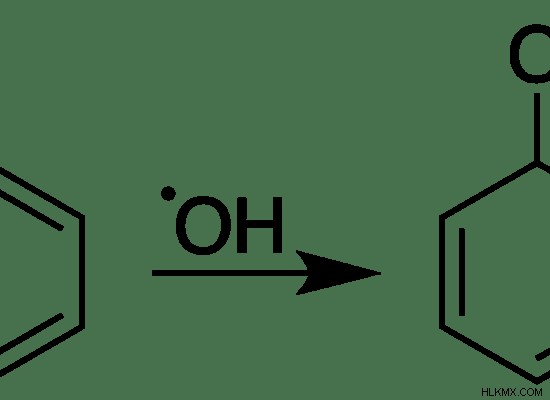
그림 03 :벤젠과의“.OH”의 반응은 새로운 라디칼을 형성합니다.
사이클로 addition
두 주기적 또는 비 사이 클릭 분자의 조합으로부터 순환 분자의 형성은 시클로 addition으로 알려져있다. Diels-Alder 반응은 Cyclo-addition의 좋은 예입니다.
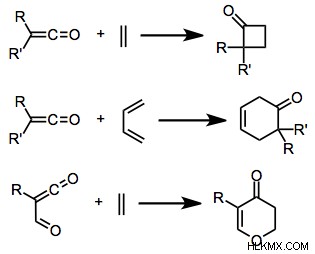
그림 4 :사이클로 addition의 예
위의 이미지는 알켄과 함께 카르복실산 화합물의 첨가를 보여줍니다. 이러한 첨가물은 주기적 화합물의 형성을 초래했습니다.
대체 반응이란 무엇인가
치환 반응은 다른 원자 또는 원자 그룹에 의한 원자 또는 원자 그룹을 대체하는 반응입니다. 이로 인해 leavement group 이라는 부산물이 있습니다. . 치환 반응의 일반적인 분류 (치환기의 유형에 따라)는 다음과 같습니다.
- elecropholic substitution
- 친 핵성 치환
- 라디칼 치환
전자 성 치환
electrophilic substitution은 electrophile에 의한 원자 또는 기능 그룹을 대체하는 것입니다. 여기서, electrophile은 전자가 풍부한 종으로부터 전자 쌍을 수용 할 수있는 원자 또는 분자이며 양전하 또는 중성 전하를 낳습니다.

그림 05 :NO2+의 벤젠으로의 전자 성 치환
위의 예에서 벤젠 고리의 하나의 수소 원자는 no 2 로 변위됩니다. . 여기서,
친 핵성 치환
친 핵성 치환은 원자 또는 기능적 그룹을 친핵체로 대체하는 것입니다. 여기서, 친핵체는 전자 쌍을 기증 할 수 있고 음전하가 있거나 중립적으로 하전되는 원자 또는 분자이다.
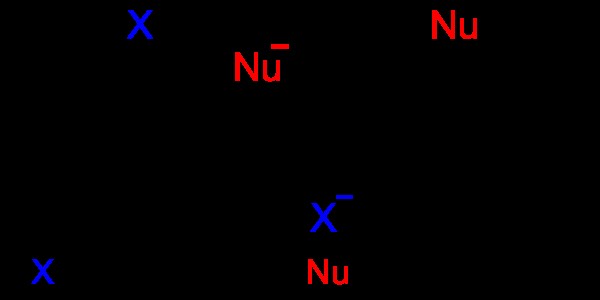
그림 06 :방향족 친 핵성 치환
위의 이미지에서 "Nu"는 친핵체를 나타내고 방향족 분자의 "x"원자를 대체합니다. "X"원자는 떠나는 그룹입니다.
라디칼 치환
라디칼 대체에는 기질과의 라디칼의 반응이 포함됩니다. 라디칼 치환은 또한 반응의 완료를위한 적어도 두 단계 (라디칼 첨가 반응에서와 동일)를 함유한다. 대부분의 시간에는 세 단계가 관련되어 있습니다.
- 라디칼의 시작-
- 전파- 라디칼은 비 방사제와 반응하여 새로운 라디칼을 형성합니다
- 종료- 두 개의 라디칼이 결합되고 새로운 라디칼의 형성이 종료됩니다
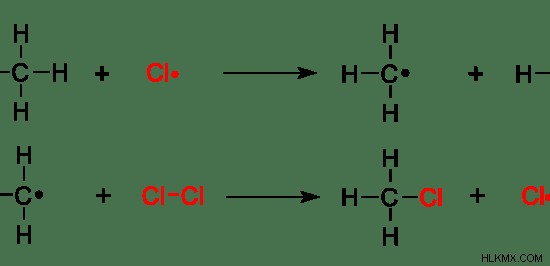
그림 7 :메탄의 라디칼 치환
위의 예에서 메탄의 수소 원자는 "Cl"라디칼로 대체됩니다. 수소 원자는 떠나는 그룹입니다.
첨가와 치환 반응의 차이
정의
추가 반응 : 첨가 반응은 큰 분자를 형성하기 위해 둘 이상의 원자 또는 분자의 조합입니다.
치환 반응 : 치환 반응은 다른 원자 또는 원자 그룹에 의한 원자 또는 원자 그룹을 대체하는 반응입니다.
최종 분자
추가 반응 : 첨가 반응 후 형성된 큰 분자를 부가 물이라고합니다.
대체 반응 : Electrophile 또는 leavect 그룹을 제외한 분자의 일부를 기질이라고합니다.
부산물
추가 반응 : 부산물은 추가 반응에서 형성되지 않습니다.
치환 반응 : 부산물은 치환 반응에서 형성된다. 부산물은 떠나는 그룹입니다.
기판 또는 부가 물의 몰 질량
추가 반응 : 부가 물의 몰 질량 추가 반응의 몰 질량은 새로운 원자 또는 그룹의 조합으로 인해 초기 분자보다 항상 증가합니다.
대체 반응 : 치환 반응에서 기질의 몰 질량은 치환기에 따라 초기 분자의 것보다 증가 또는 감소 될 수있다.
.결론
추가 및 대체 반응은 유기 화학의 반응 메커니즘을 설명하는 데 사용됩니다. 첨가 및 치환 반응의 주요 차이점은 첨가 반응은 둘 이상의 원자 또는 기능 그룹의 조합을 포함한다는 것입니다. 대체 반응은 다른 기능 그룹에 의한 원자 또는 기능적 그룹의 변위를 포함한다는 것입니다.
이미지 제공 :
1. Omegakent의“Electrophilic Addition Hydron 메커니즘” - Commons Wikimedia
2를 통한 자신의 작업 (공개 도메인). Sponk (Talk)의 "Aldehyde Hydrate Formation" - Commons Wikimedia
3을 통한 자신의 작업 (공개 도메인). DMacks (Talk)의“벤젠 하이드 록실 반응” - Commons Wikimedia
4를 통한 자신의 작업 (공개 도메인). Organicreations에 의한“Ketgen” - Commons Wikimedia
5를 통한 자체 작업 (CC x 3.0). Benjah-BMM27의“Benzene-Nitration-Mechanisis”-Commons Wikimedia
6을 통한 자체 작업 (공개 도메인). Commons Wikimedia
7을 통한 "방향족 친 핵성 치환"공개 도메인). Commons Wikimedia를 통해 English Wikipedia (CC By-SA 3.0)의 V8rik의 "MethanechlorinationPropagationStep"