주요 차이 - 1 차 vs Zero Order Kinetics
화학 동역학은 화학 반응의 속도를 설명합니다. 화학 동역학의 개념은 대량 행동 법칙에 의해 처음 개발되었습니다. 질량 작용의 법칙은 화학 반응의 속도가 반응물 질량에 비례한다는 것을 설명합니다. 화학 동역학에 따르면, 반응은 0 차 반응, 1 차 반응 및 2 차 반응으로 분류 될 수있다. 주요 차이 1 차와 제로 차수 동역학 사이에서 1 차 동역학의 속도는 하나의 반응물의 농도에 의존하는 반면, 제로 차수 동역학의 속도는 반응물의 농도에 의존하지 않는다는 것입니다.
주요 영역을 다루었습니다
1. 첫 번째 순서 동역학은 무엇입니까
- 정의, 속성, 예
2. Zero Order Kinetics
- 정의, 속성, 예
3. 1 차와 제로 주문 동역학의 차이점은 무엇입니까
- 주요 차이점 비교
주요 용어 :집중, 1 차 동역학, 동역학, 질량 행동 법칙, 금리 상수, 요율 법, 반응 속도, 제로 주문 동역학 
첫 번째 순서 동역학은 무엇입니까
1 차 동역학은 반응 속도가 하나의 반응물의 몰 농도에 의존하는 화학 반응을 말합니다. 반응의 속도는 하나의 반응물의 농도에 비례한다. 화학 반응에 참여하는 다른 반응물이 많이있을 수 있지만, 하나의 반응물만이 반응의 속도를 결정합니다. 따라서, 다른 반응물은이 특정 반응과 관련하여 제로 순서로 알려져 있습니다.
예를 들어, 펜 독 사이드의 분해를 고려해 봅시다 (n 2 o 5 ). 이것은 단 분자 반응입니다. 즉,이 반응은 단 하나의 반응물로 구성됩니다. 반응 속도는 다음과 같이 주어질 수 있습니다.
2n 2 o 5 (g) → 4NO 2 (g) + o 2 (g)
rate =k [n 2 o 5 (g) ]
k는 속도 상수이고 [n 2 입니다 o 5 (g) ]는 n < 2 의 농도입니다 o 5 (g) . 문자 "m"은 n < 2 의 농도에 관한 반응의 순서를 제공합니다. o 5 (g) . 위의 방정식은 요율 법으로 알려져 있으며 상기 방정식에 대해 M =1입니다. 그런 다음 반응 속도는 다음과 같이 주어질 수 있습니다.
rate =k [n 2 o 5 (g ]
m의 값은 실험적으로 얻을 수 있습니다. 여기서 값은 항상 하나 일 것입니다. 이는 n < 2 의 분해를 나타냅니다 o 5 (g) 1 차 반응입니다. 또한, 반응의 순서는 반응물의 화학량 론적 계수와 동일하거나 동일 할 수 없을 수있다. 위의 예에서, 화학량 론적 계수는 2이지만 반응 순서는 1이다. 첫 번째 순서 반응의 속도는 아래와 같이 그래프에 표시 될 수있다.
.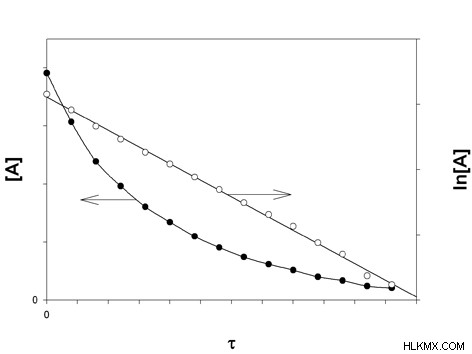
그림 1 :1 차 동역학의 그래프
위의 다이어그램에서 어두운 점이있는 그래프는 반응 농도 대 반응 시간의 그래프입니다. 반응의 속도가 반응물의 농도에 따라 변경됨을 나타내는 곡선 그래프입니다. 흰색 점을 가진 그래프는 LN [반응물 농도] 대 반응 시간의 그래프를 보여줍니다. 선형 그래프입니다.
Zero Order kinetics
Zero Order 동역학은 반응 속도가 반응물 농도에 의존하지 않는 화학 반응을 말합니다. 다시 말해, 반응물의 농도는 반응 속도에 영향을 미치지 않습니다. 따라서 온도가 일정하다면 반응 속도는 0 차로 일정합니다.
반응물이 존재하는 것이 무엇인지, 농도가 어느 정도 바뀌 었더라도 반응 속도는 동일하게 유지됩니다. 따라서 반응 속도는
로 제공됩니다rate =k
여기서 k는 속도 상수입니다.
제로 차수 반응에 대한 좋은 예는 촉매로서 백금의 존재하에 아산화 질소의 분해입니다.
2n 2 o (g) → 2n 2 (g) +o 2 (g)
이 반응의 속도는 속도 상수와 같습니다. 따라서 반응 속도는 다음과 같이 주어질 수 있습니다.
rate =k [n 2 o (g) ]
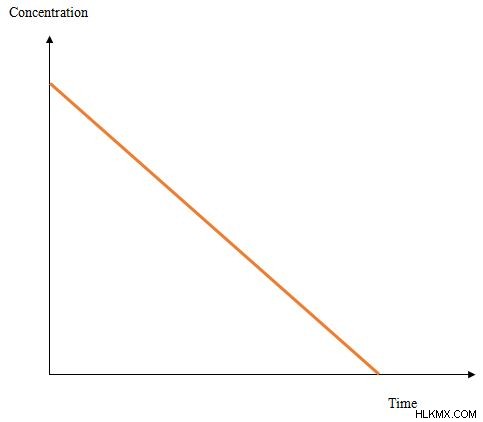
그림 2 :반응물 농도 대 반응 시간의 그래프
위의 그래프는 0 차 순서 동역학에 대한 반응 시간에 대한 반응물 농도의 변화를 보여줍니다. 선형 그래프입니다.
1 차와 제로 주문 동역학의 차이
정의
첫 번째 주문 동역학 : 1 차 동역학은 반응 속도가 하나의 반응물의 몰 농도에 의존하는 화학 반응을 말합니다.
Zero Order Kinetics : 제로 순서 동역학은 반응의 비율이 반응물 농도에 의존하지 않는 화학 반응을 말합니다.
반응물 농도의 그래프 대 시간
1 차 동역학 : 반응물 농도의 그래프 대 1 차 동역학 시간 시간은 곡선 그래프입니다.
제로 주문 동역학 : 0 차 순서 동역학에 대한 반응물 농도의 그래프는 선형 그래프입니다.
반응물 농도
1 차 동역학 : 첫 번째 순서 동역학 반응은 반응물 농도에 따라 다릅니다.
제로 주문 동역학 : 제로 차수 운동 반응은 반응물 농도에 의존하지 않습니다.
법률
첫 번째 주문 동역학 : 제 1 차 운동 반응의 속도 법칙에는 반응물 농도를 곱한 속도 상수가 포함됩니다.
제로 주문 동역학 : 제로 주문 운동 반응의 요율 법률에는 속도 상수 만 포함됩니다.
결론
요율 법 또는 요율 방정식은 시스템의 화학적 동역학에 대한 가장 중요한 세부 사항을 제공합니다. 반응물 농도에 관한 특정 반응의 속도 및 일정한 온도에서의 속도 상수를 설명한다. 화학 반응의 동역학에 따르면 세 가지 주요 반응이 있습니다. 그것들은 제로 주문 반응, 1 차, 반응 및 2 차 반응입니다. 이러한 반응은 특정 시스템에 존재하는 반응물에 대한 반응 순서에 따라 서로 다릅니다.