주요 차이 - 하이드 록실 대 하이드 록 사이드
두 용어 하이드 록실과 수산화 구조가 유사하고 유사한 화학 구조를 가지고 있지만 여러 가지 방법으로 서로 다릅니다. 하이드 록실이라는 용어는 공유 결합을 통해 분자에 결합 된 원자 그룹 (하나의 산소 원자 및 하나의 수소 원자)에 주어진 이름이다. 수산화물이라는 용어는 하나의 산소 원자와 하나의 수소 원자로 구성된 음이온을 지칭합니다. IUPAC 규칙에 따르면 Hydroxyl은 OH 라디칼이고 –oh 그룹은 Hydroxy라는 이름이 부여됩니다. 그러나, 공통적으로, 우리는 히드 록실 그룹이라는 용어를 사용하여 –oh 기능 그룹을 참조합니다. 하이드 록실과 히드 록시드의 주요 차이점은 하이드 록실이 자유 형태로 제공되지 않는 반면, 수산화물은 음이온으로 자유 형태로 발견 될 수 있다는 것입니다.
주요 영역을 다루었습니다
1. 하이드 록실
- 정의, 예제 및 반응
2. 수산화물이란 무엇입니까
- 정의, 예제 및 반응
3. 하이드 록실과 수산화물의 차이점은 무엇입니까
- 주요 차이점 비교
주요 용어 :음이온, 공유 결합, 수산화물, 하이드 록실
하이드 록실
하이드 록실은 분자에 결합 된 원자 그룹입니다. 따라서, 그것은 항상 분자의 일부로 발견됩니다. 유리 형태의 하이드 록실은 불안정한 라디칼이고 라디칼이 안정화되기 위해 다른 분자와 반응하기 때문에 기존의 자유 형태의 하이드 록실기가 없다. 히드 록실 그룹은 유기 및 무기 분자 모두에서 발견 될 수 있습니다.
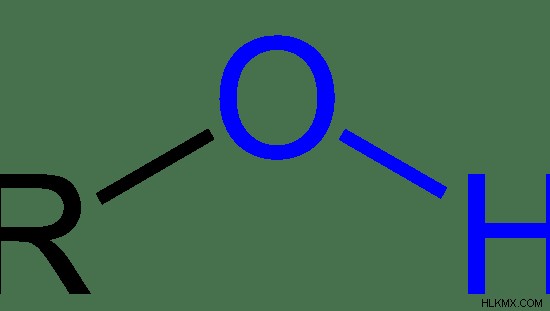
그림 1 :하이드 록실 그룹은 청색입니다. "R"은 나머지 분자를 나타냅니다.
하이드 록실 그룹은 항상 공유 결합을 형성합니다. 따라서, 히드 록실기는 공유 화합물에서만 발견된다. 하이드 록실기를 함유하는 가장 일반적인 유기 화합물은 알코올 및 카르 복실 산입니다. 여기서, 하이드 록실 그룹은 해당 분자의 기능적 그룹으로서 작용한다. 나머지 분자의 화학적 및 물리적 특성은 그것에 부착 된 하이드 록실 그룹에 의해 결정됩니다.
하이드 록실 그룹은 무기 화합물에서도 발견됩니다. 예를 들어, 황산 및 인산과 같은 일부 산은 하이드 록실기로 구성됩니다. 하이드 록실기는 또한 화합물의 화학적 특성에 기여한다. 하이드 록실 그룹은 강한 수소 결합을 형성 할 수 있습니다.
hydroxide
하이드 록 사이드는 무기 음이온입니다. 그것은 공유 결합을 통해 수소 원자에 결합 된 하나의 산소 원자로 구성됩니다. 이 음이온은 -1 가하입니다. 이 전하는 산소 원자에 여분의 전자가 존재하기 때문에 산소 원자에 있습니다. 수산화 음이온은 안정적인 화합물입니다. 수산화 음이온의 화학적 기호는 OH입니다.
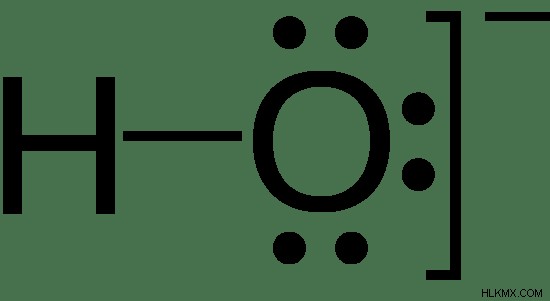
그림 2 :수산화 음이온
하이드 록 사이드는 이온 성 화합물에서 찾을 수 있습니다. 그것은 이온 성 화합물의 형성에 대한 음의 이온 역할을한다. 수산화물 이온은 시스템의 염기성을 담당하는 화학 종입니다. 시스템의 염기성은 해당 시스템에 존재하는 수산화물 이온의 양을 측정하여 결정할 수 있습니다. 기본 화합물에서, 해당 화합물의 염기성은 제거 될 수있는 수산화물 그룹의 존재에 의해 지시된다.
.예를 들어, 수산화 나트륨 (NAOH)은 매우 기본적인 화합물이며 NA 양이온 및 OH 음이온으로 구성됩니다. 많은 금속은 수산화물 이온과 복합체를 형성 할 수 있습니다. 그들은 금속 수산화물이라고합니다. 수산화물 이온은 친핵체 역할을 할 수 있습니다. 여기서, 이들 수산화물 이온은 부분 양전하로 탄소 원자를 공격 할 수있다; 때때로, 수산화물 이온은 또한 반응물의 촉매로서 작용한다. 이것을 기본 촉매라고합니다.
하이드 록실과 수산화물의 차이
정의
하이드 록실 : 하이드 록실은 분자에 결합 된 원자 그룹입니다.
수산화물 : 수산화물은 무기 음이온입니다.
자연
하이드 록실 : 히드 록실기는 항상 분자에 결합 된 원자 그룹으로 발견됩니다.
수산화물 : 수산화물은 음이온으로 자유 형태로 발견 될 수 있습니다.
화학적 결합
하이드 록실 : 하이드 록실 그룹은 공유 결합을 형성 할 수있다.
수산화물 : 수산화물 그룹은 이온 결합을 형성 할 수 있습니다.
전하
하이드 록실 : 하이드 록실 그룹은 고정 된 전하가 없습니다.
수산화물 : 수산화물은 -1 전하를 갖는 음이온입니다.
반응성
하이드 록실 : 히드 록실 그룹은 분자의 기능적 그룹으로서 작용한다.
수산화물 : 수산화물 이온은 이온 성 화합물을 형성하기 위해 양이온과 반응합니다.
결론
용어 하이드 록실 그룹과 수산화물 그룹이 상호 교환 적으로 사용되지만이 용어 사이에는 몇 가지 차이가 있습니다. 하이드 록실과 수산화물의 주요 차이점은 하이드 록실이 자유 형태로 이용 가능하지 않지만 수산화물은 음이온으로 자유 형태로 발견 될 수 있다는 것입니다.
.