주요 차이 - 쉘 대 서브 쉘 대 궤도
Atom은 물질을 구성하는 기본 단위입니다. 과거에는 과학자들이 원자를 더 이상 나눌 수 없다고 믿었습니다. 그러나 나중에 발견 된 아 원자 입자에 대한 정보가 밝혀졌으며, 이는 원자가 아 원자 입자로 더 나눌 수 있음을 나타냈다. 세 가지 주요 아 원자 입자는 전자, 양성자 및 중성자입니다. 양성자와 중성자는 함께 원자의 중심 코어 인 핵을 만듭니다. 전자는이 핵 주위에서 지속적인 움직임에 있습니다. 우리는 전자의 정확한 위치를 결정할 수 없습니다. 그러나 전자는 특정 경로에서 움직입니다. 쉘, 서브 쉘 및 궤도라는 용어는 전자가 움직일 수있는 가장 가능한 경로를 나타냅니다. 쉘 서브 쉘과 궤도의 주요 차이점은 쉘은 동일한 주요 양자 수를 공유하는 전자로 구성되어 있다는 것입니다. 서브 쉘은 동일한 각 운동량 양자 수를 공유하는 전자로 구성되지만 궤도는 동일한 에너지 수준이지만 다른 스핀을 갖는 전자로 구성됩니다. .
주요 영역을 다루었습니다
1. 쉘
- 정의, 구조 및 속성
2. 서브 쉘은 무엇입니까
- 정의, 구조 및 속성
3. 궤도
란? - 정의, 구조 및 속성
4. 쉘 서브 쉘과 궤도의 차이점은 무엇입니까
- 주요 차이점 비교
주요 용어 :원자, 전자, 궤도, 양자 번호, 쉘, 서브 쉘 
쉘이란 무엇입니까
껍질은 원자의 핵 주위의 전자와 경로입니다. 이 쉘은 해당 쉘의 전자가 구성된 에너지에 따라 핵 주위에 배열되기 때문에 이들은 에너지 레벨이라고도합니다. 에너지가 가장 낮은 껍질은 핵에 가장 가깝습니다. 다음 에너지 수준은 그 껍질 너머에 위치합니다.
이 쉘을 인식하기 위해, 그들은 가장 낮은 에너지 레벨의 쉘은 k 쉘입니다. 그러나 과학자들은 양자 번호를 사용 하여이 껍질을 지명했습니다. 각 껍질에는 자체 양자 번호가 있습니다. 쉘에 대한 양자 번호는 주요 양자 수로 명명됩니다. 그런 다음 가장 낮은 에너지 수준의 쉘은 n =1입니다.
모든 쉘은 동일한 수의 전자를 보유하지 않습니다. 최저 에너지 수준은 최대 2 개의 전자 만 보유 할 수 있습니다. 다음 에너지 수준은 최대 8 개의 전자를 유지할 수 있습니다. 껍질이 잡을 수있는 전자 수의 패턴이 있습니다. 이 패턴은 다음과 같습니다.
|
주요 양자 수 (n)
|
최대 전자 수
|
|
n =1
|
2
|
|
n =2
|
8
|
|
n =3
|
18
|
|
n =4
|
32
|
|
n =5
|
32
|
|
n =6
|
32
|
따라서 쉘을 잡을 수있는 최대 전자 수는 32입니다. 쉘은 32 개 이상의 전자를 가질 수 없습니다. 높은 껍질은 하위 껍질보다 더 많은 전자를 보유 할 수 있습니다.
이 껍질의 존재는 원자의 에너지가 양자화되었음을 나타냅니다. 다시 말해, 핵 주위의 움직임에있는 전자에 대한 불연속 에너지 값이 있습니다.
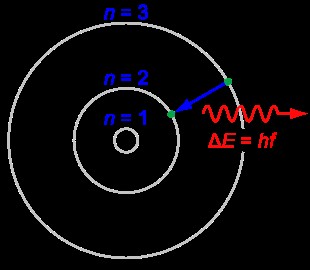
그림 1 :원자 쉘
이 껍질의 전자는 에너지를 흡수하거나 방출하여 한 껍질에서 다른 껍질로 전달 될 수 있습니다. 흡수되거나 방출되는 에너지의 양은 두 껍질 사이의 에너지 차이와 동일해야합니다. 그렇지 않다면,이 전환은 발생하지 않을 것입니다.
서브 쉘
서브 쉘은 전자가 쉘 내에서 움직이는 영역입니다. 이들은 각 운동량 양자 수에 따라 명명되었습니다. 쉘에서 찾을 수있는 4 가지 주요 유형의 서브 쉘이 있습니다. 그것들은 s, p, d, f로 명명되었습니다. 각 서브 쉘은 여러 궤도로 구성됩니다. 서브 쉘에있는 궤도의 수는 다음과 같습니다.
|
서브 쉘
|
궤도 수
|
최대 전자 수
|
|
s
|
1
|
2
|
|
p
|
3
|
6
|
|
d
|
5
|
10
|
|
f
|
7
|
14
|
이 서브 쉘은 또한 그들이 구성된 에너지에 따라 배열됩니다. 하부 껍질에서, 서브 쉘의 에너지의 오름차순 순서는 s
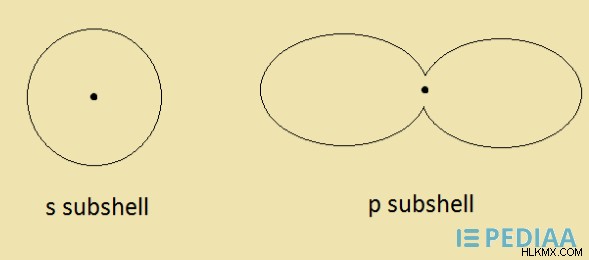
그림 02 :서브 쉘 모양
이 서브 쉘에는 고유 한 3D 구조가 있습니다. S 서브 쉘은 구형입니다. P 서브 쉘은 아령 모양입니다. 이 모양은 위에 나와 있습니다.
궤도
Orbital은 전자의 파도와 같은 동작을 설명하는 수학적 함수입니다. 다시 말해, 궤도라는 용어는 전자의 정확한 움직임을 설명합니다. 서브 쉘은 궤도로 구성됩니다. 서브 쉘이 가진 궤도의 수는 서브 쉘에 따라 다릅니다. 이것은 서브 쉘에 존재하는 궤도의 수가 서브 쉘의 독특한 기능이라는 것을 의미합니다.
|
서브 쉘
|
궤도 수
|
|
s
|
1
|
|
p
|
3
|
|
d
|
5
|
|
f
|
10
|
그러나 하나의 궤도는 최대 2 개의 전자 만 담을 수 있습니다. 이 전자는 동일한 에너지 수준이지만 스핀에 따라 서로 다릅니다. 그들은 항상 반대편 스핀을 가지고 있습니다. 전자가 궤도에 채워지면 헌드의 규칙에 따라 채워집니다. 이 규칙은 서브 쉘의 모든 궤도가 궤도가 이중으로 결합되기 전에 전자로 단독으로 점유되어 있음을 나타냅니다.
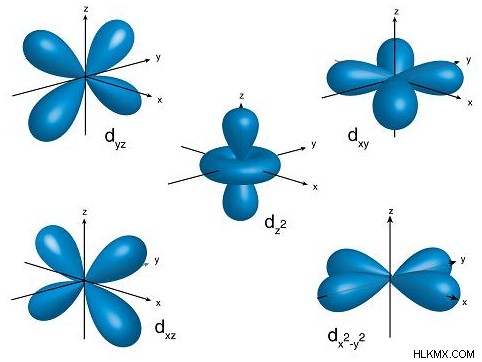
그림 3 :d 궤도 형태
위의 이미지는 d 궤도의 모양을 보여줍니다. 하나의 d 서브 쉘은 5 개의 궤도로 구성되므로 위의 이미지는이 궤도의 5 가지 모양을 보여줍니다.
쉘 서브 쉘과 궤도의 차이
정의
쉘 : 쉘은 원자의 핵 주위의 전자가 뒤 따르는 경로입니다.
서브 쉘 : 서브 쉘은 전자가 쉘 내에서 움직이는 경로입니다.
궤도 : 궤도는 전자의 파도와 같은 동작을 설명하는 수학적 함수입니다.
양자 번호의 이름
쉘 : 쉘은 주요 양자 수가 제공됩니다.
서브 쉘 : 서브 쉘은 각 운동량 양자 수가 제공됩니다.
궤도 : 궤도에는 자기 양자 수가 제공됩니다.
최대 전자 수
쉘 : 쉘은 최대 32 개의 전자를 유지할 수 있습니다.
서브 쉘 : 서브 쉘이 보유 할 수있는 최대 전자 수는 서브 쉘 유형에 따라 다릅니다.
궤도 : 궤도가 잡을 수있는 최대 전자 수는 2입니다.
결론
원자는 전자, 양성자 및 중성자로 구성됩니다. 양성자와 중성자는 핵에 있습니다. 전자는 핵 주위에 구름을 형성합니다. 이 전자 구름에는 일정한 움직임이있는 전자가 있습니다. 추가 발견은 이것이 단순한 구름이 아니라는 것을 발견했습니다. 전자가 움직이는 양자화 된 에너지 수준이 있습니다. 그들은 전자가 움직일 경로처럼 보입니다. 쉘, 서브 쉘 및 궤도라는 용어는 이러한 경로를 설명하는 데 사용됩니다. 쉘 서브 쉘과 궤도의 주요 차이점은 쉘은 동일한 주요 양자 수를 공유하는 전자로 구성되어 있으며 서브 쉘은 동일한 각 운동량 양자 수를 공유하는 전자로 구성되며, 궤도는 동일한 에너지 수준이지만 다른 스핀을 갖는 전자로 구성됩니다.
.