주요 차이 - 톨루엔 대 벤젠
벤젠과 톨루엔은 유기 화합물입니다. 이들은 이중 결합을 함유하는 고리 구조로 구성되기 때문에 방향족 화합물이라고한다. 다시 말해, 그것들은 불포화 고리 구조입니다. 벤젠 및 톨루엔은 많은 합성 반응의 시작 물질로 사용됩니다. 이 기사는 구조적 유사성과 톨루엔과 벤젠의 차이와 특성 및 유용한 반응에 대한 정보와 함께 설명합니다. 톨루엔은 벤젠의 유도체입니다. 톨루엔과 벤젠의 주요 차이점은 톨루엔이 벤젠 고리에 부착 된 메틸기를 갖는 반면 벤젠은 치환되지 않은 고리 구조를 가지고 있다는 것입니다.
주요 영역을 다루었습니다
1. 톨루엔이란?
- 정의, 속성 및 반응
2. 벤젠이란?
- 정의, 속성 및 반응
3. 톨루엔과 벤젠의 유사점은 무엇입니까
- 일반적인 기능의 개요
4. 톨루엔과 벤젠의 차이점은 무엇입니까
- 주요 차이점 비교
주요 용어 :벤젠, 발암 성, 메틸 그룹, 톨루엔, 불포화 링

톨루엔이란?
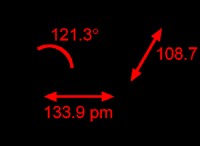
톨루엔은 벤젠 고리를 메틸기에 부착하는 유기 화합물입니다. 톨루엔의 화학적 공식은 c 7 입니다 H 8 . 톨루엔의 몰 질량은 약 92.14 g/mol입니다. 실온과 압력에서는 달콤한 매운 냄새를 가진 무색 액체로 보입니다. 톨루엔의 IUPAC 이름은 메틸 벤젠입니다.

그림 1 :톨루엔의 화학 구조
톨루엔의 끓는점은 약 111c입니다. 가연성 액체 화합물입니다. 톨루엔은 벤젠 유도체로 간주됩니다. 그것은 전자 성 방향족 치환 반응을 겪을 수 있습니다. 톨루엔은 메틸기의 존재로 인해 반응성이 높다. 메틸기는 좋은 전자 방출 그룹입니다. 따라서, 톨루엔 분자에 존재하는 메틸기는 벤젠 고리를보다 전자를 풍부하게 만드는 데 도움이된다. 따라서 전기와 전자를 쉽게 공유 할 수 있습니다.
톨루엔이 겪는 가장 일반적인 반응은 다음과 같습니다.
- 톨루엔과 칼륨 과망간산염 사이의 반응은 벤조산을줍니다. 칼륨 과망간산염은 강한 산화제이므로 메틸기를 카르 복실 그룹으로 산화시킬 수 있습니다.
- 톨루엔은 할로겐화를 겪을 수 있습니다. HBR로 브로마로 만들 수 있습니다.
- 톨루엔의 메틸 그룹은 매우 강한 조건에서 탈 양성자 화 될 수 있습니다.
toluene은 유기 반응에서 매우 유용합니다. 벤젠을 생산하는 출발 재료로 사용될 수 있습니다. 그것은 메탄과 함께 벤젠 분자를 제공합니다 (ch 4 . ) 최종 제품으로서의 분자. 톨루엔은 페인트 생산에 일반적으로 사용되는 훌륭한 용매입니다. 또한 가연성이 높기 때문에 때때로 연료로 사용됩니다. 그러나 톨루엔은 독성 화합물로 간주됩니다.
벤젠이란?
벤젠은 화학식 c 6 를 갖는 방향족 화합물입니다. H 6 . 벤젠의 몰 질량은 약 78.11 g/mol입니다. 실온 및 압력에서 무색 액체로 보이며 휘발유와 같은 냄새가납니다. 벤젠 분자는 이중 결합으로 인한 불포화를 갖는 평면 구조입니다.
벤젠의 끓는점은 약 80.1c입니다. 벤젠은 원유의 천연 구성 요소로 발견 될 수 있습니다. 벤젠의 구조는 3 개의 이중 결합으로 주기적으로 부착 된 6 개의 SP 하이브리드 화 된 탄소 원자로 구성되어야하지만, 실제 벤젠 구조는 탄소 원자들 사이에 구별 가능한 이중 및 단일 결합이 없다. 실제 구조는 벤젠 분자의 평면 구조 위와 아래의 2 개의 전자 구름처럼 보인다. 이것을 전자의 탈소 화라고합니다. 이것이 가장 먼저 Kekule이라는 독일 화학자였습니다.
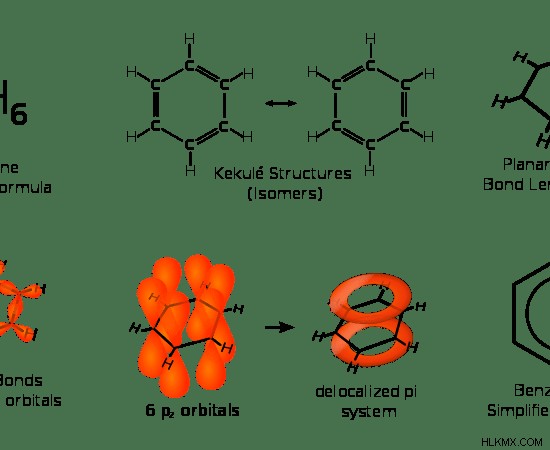
그림 2 :벤젠의 화학 구조의 다른 표현
벤젠은 전자 성 방향족 치환 반응을 겪습니다. 그것은 벤젠의 전자가 풍부한 특성 때문입니다. 벤젠 분자에 존재하는 전자 구름은 전기성과 전자를 공유 할 수 있습니다. 따라서 벤젠은 친핵체로 간주됩니다. 벤젠을 출발 물질로 사용하여 생성 된 벤젠의 많은 유도체가 있습니다. 벤젠의 수소화는 사이클로 헥산을 제공한다.
그러나 벤젠은 발암 성 화합물로 간주됩니다. 따라서 벤젠에 대한 노출 제한이 있습니다. 벤젠에 노출되는 경로에는 흡입, 청량 음료 (벤조산 및 아스코르브 산 및 청량 음료의 아스코르브 산이 벤젠을 형성하기 위해 서로 상호 작용할 수 있음) 및 벤젠과의 수 공급 오염이 포함됩니다.
.톨루엔과 벤젠의 유사성
- 둘 다 탄화수소입니다.
- 둘 다 방향족 화합물입니다.
- 두 화합물 모두 벤젠 고리로 구성됩니다.
- 둘 다 불포화 화합물입니다.
- 둘 다 여러 SP 하이브리드 화 된 탄소 원자로 구성됩니다.
톨루엔과 벤젠의 차이
정의
톨루엔 : 톨루엔은 메틸기에 부착 된 벤젠 고리를 갖는 유기 화합물입니다.
벤젠 : 벤젠은 화학식 C 6 를 갖는 방향족 화합물입니다. H 6 .
몰 질량
톨루엔 : 톨루엔의 몰 질량은 약 92.14 g/mol.
입니다벤젠 : 벤젠의 몰 질량은 약 78.11 g/mol.
입니다냄새
톨루엔 : 톨루엔은 달콤하고 매운 냄새가 있습니다.
벤젠 : 벤젠은 휘발유와 같은 냄새가 있습니다.
비등점
톨루엔 : 톨루엔의 끓는점은 약 111c입니다.
벤젠 : 벤젠의 끓는점은 약 80.1c입니다.
화학 반응성
톨루엔 : 톨루엔은 벤젠에 비해 매우 반응성입니다.
벤젠 : 벤젠은 톨루엔에 비해 덜 반응성입니다.
탄소 원자의 혼성화
톨루엔 : 톨루엔은 SP 하이브리드 화 된 탄소 원자와 SP 하이브리드 화 된 탄소 원자로 구성됩니다.
벤젠 : 벤젠은 SP 하이브리드 화 된 탄소 원자로 만 구성됩니다.
측면 그룹
톨루엔 : 톨루엔은 측면 그룹으로서 메틸 그룹을 가지고있다.
벤젠 : 벤젠은 측면 그룹이 없습니다.
결론
톨루엔과 벤젠은 두 가지 관련 유기 화합물입니다. 톨루엔은 벤젠의 유도체입니다. 톨루엔과 벤젠의 주요 차이점은 톨루엔에 메틸기의 존재 인 반면 벤젠은 메틸기가 부착되지 않았다. 화학 구조에서 약간의 차이이지만 톨루엔과 벤젠의 많은 특성을 초래합니다.