주요 차이 - 여기 대 이온화 전위
여기 및 이온화 전위는 화학 요소의 전자와 원자 핵 사이의 관계를 설명하기 위해 화학에 사용되는 두 가지 용어입니다. 원자 핵은 양성자와 중성자로 구성됩니다. 따라서 그들은 긍정적으로 청구됩니다. 특정 에너지 수준을 따라 핵 주위에 이동하는 전자가 있습니다. 전자는 음으로 하전됩니다. 여기는 에너지를 흡수함으로써 전자가 낮은 에너지 수준에서 더 높은 에너지 수준으로의 이동입니다. 그것은 원자를 접지 상태에서 여기 상태로 이동시킵니다. 이온화 에너지는 중성 기체 원자에서 전자를 제거하는 것입니다. 이것은 양이온을 만듭니다. 전자가 제거 될 때, 원자는 원자의 양전하를 중화시키는 음전하가 없다. 흥분과 이온화 전위의 주요 차이점은 여기에 전자가 더 낮은 에너지 수준에서 더 높은 에너지 수준으로 전자의 움직임을 설명하는 반면, 이온화 전위는 에너지 수준에서 전자의 완전한 제거를 설명한다. .
주요 영역을 다루었습니다
1. 흥분이란 무엇입니까
- 정의, 설명, 전자기 스펙트럼
2. 이온화 전위
- 정의, 제 1 이온화 에너지, 제 2 이온화 에너지
3. 여기와 이온화 전위의 차이는 무엇입니까
- 주요 차이점 비교
주요 용어 :원자 핵, 전자기 스펙트럼, 전자, 여기, 여기 상태,지면 상태, 이온화 에너지, 이온화 전위

여기 란?
화학에서 여기는 원자 핵, 원자 또는 분자와 같은 시스템에 불연속 에너지를 추가하는 것입니다. 흥분은지면 에너지 상태에서 흥분된 에너지 상태로 시스템의 에너지를 변화시킵니다.
흥분된 시스템 상태는 에너지 분포가 아닌 개별 값을 갖습니다. 이는 흥분이 원자 (또는 위에서 언급 한 다른 시스템)가 특정 부분의 에너지를 흡수 할 때만 발생하기 때문입니다. 예를 들어, 전자를 여기 상태로 이동시키기 위해, 주어져야하는 에너지의 양은지면 상태와 여기 상태 사이의 에너지 차이와 같습니다. 주어진 에너지 가이 에너지 차이와 같지 않으면 여기는 발생하지 않습니다.
원자 핵의 전자, 양성자 및 중성자와 동일 해야하는 에너지가 주어질 때 흥분 될 수 있습니다. 그러나 핵을 여기 상태로 이동시키는 데 필요한 에너지는 전자와 비교할 때 매우 높습니다.
시스템은 높은 에너지를 가진 여기 상태가 안정적이지 않기 때문에 시스템은 오랫동안 여기 상태에 남아 있지 않습니다. 따라서 시스템은이 에너지를 방출하고 접지 상태로 돌아와야합니다. 에너지는 광자로서 양자 에너지의 방출 형태로 방출됩니다. 일반적으로 가시 광선 또는 감마 방사선 형태로 발생합니다. 이 반환을 붕괴라고합니다. 붕괴는 흥분의 역수입니다.
전자기 스펙트럼
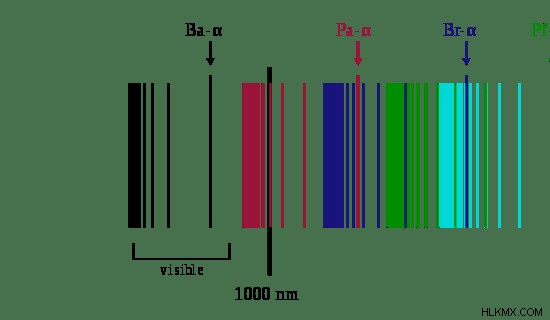
그림 1 :수소의 전자기 스펙트럼
전자가 에너지를 흡수하고 흥분된 상태로 오면 동일한 양의 에너지를 방출하여지면 상태로 돌아갑니다. 이 방출 에너지는 전자기 스펙트럼의 형성으로 이어진다. 전자기 스펙트럼은 일련의 라인입니다. 각 선은 지상 상태로 돌아올 때 방출되는 에너지를 나타냅니다.
이온화 전위
이온화 전위 또는 이온화 에너지는 중립적 인 기체 원자에서 가장 느슨하게 결합 된 전자를 제거하는 데 필요한 에너지의 양입니다. 이 전자는 원자가 핵에서 가장 먼 전자이기 때문에 원자가 전자입니다. 중성 원자의 이온화는 양이온의 형성을 유발합니다.
이 전자의 제거는 흡열 과정으로, 에너지가 외부에서 흡수됩니다. 따라서, 이온화 전위는 양수 값이다. 일반적으로 원자 핵에 전자가 더 가까워서 이온화 전위가 높아집니다.
주기율표의 요소의 경우, 제 1 이온화 에너지, 제 2 이온화 에너지, 제 3 이온화 에너지 등으로 제공되는 이온화 전위가 있습니다. 첫 번째 이온화 에너지는 중성 가스 원자에서 전자를 제거하는 데 필요한 에너지의 양이며 양이온을 형성합니다. 그 원자의 제 2 이온화 에너지는 제 1 이온화 후 형성된 양이온에서 전자를 제거하는 데 필요한 에너지의 양입니다.
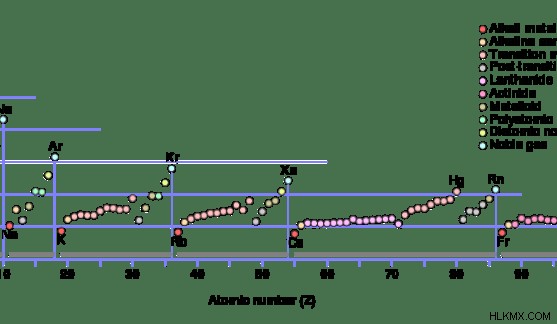
그림 2 :주기율표의 첫 번째 이온화 에너지 변화
일반적으로 이온화 에너지는 주기율표 그룹을 감소시킵니다. 이것은 원자 크기의 증가 때문입니다. 원자 크기가 증가하면 원자 핵에서 가장 먼 전자에 대한 인력이 감소합니다. 그런 다음 해당 전자를 쉽게 제거합니다. 따라서 에너지가 적어 이온화 전위가 감소합니다.
그러나 주기성 테이블의 기간을 따라 왼쪽에서 오른쪽으로 가면 이온화 에너지 패턴이 있습니다. 이온화 에너지는 요소의 전자 구성에 따라 다릅니다. 예를 들어, 그룹 2 요소의 이온화 에너지는 그룹 1 요소 및 그룹 3 요소의 이온화 에너지보다 높습니다.
여기와 이온화 전위의 차이
정의
흥분 : 여기는 원자 핵, 원자 또는 분자와 같은 시스템에 불연속 에너지를 추가하는 것입니다.
이온화 전위 : 이온화 전위는 중성의 기체 원자에서 가장 느슨하게 결합 된 전자를 제거하는 데 필요한 에너지의 양입니다.
목적
흥분 : 여기는 전자의 에너지 수준에서 더 높은 에너지 수준으로 전자의 움직임을 설명합니다.
이온화 전위 : 이온화 전위는 에너지 수준에서 전자를 완전히 제거 할 것을 설명합니다.
에너지 변화
흥분 : 여기는 외부의 에너지가 필요하지만이 에너지는 곧 광자로 방출됩니다.
이온화 전위 : 이온화 전위는 원자에 흡수되는 에너지의 양이며 다시 방출되지 않습니다.
최종 제품 안정성
흥분 : 여기는 불안정하고 수명이 짧은 흥분된 상태를 형성합니다.
이온화 전위 : 이온화 전위는 전자를 제거한 후 대부분의 시간이 안정되는 양이온을 형성합니다.
결론
화학의 흥분과 이온화 잠재력은 화학 요소의 에너지 변화와 원자 행동 사이의 관계를 설명하는 데 사용되는 두 가지 용어입니다. 여기와 이온화 전위의 주요 차이점은 여기가 낮은 에너지 수준에서 더 높은 에너지 수준으로 전자의 움직임을 설명하는 반면, 이온화 전위는 에너지 수준에서 전자의 완전한 제거를 설명한다는 것입니다.
.참조 :
1.“흥분.” 2006 년 8 월 17 일, Encyclopædia Britannica, Encyclopædia Britannica, Inc., 여기에서 제공됩니다.
2. "흥분 상태." Wikipedia, Wikimedia Foundation, 2018 년 1 월 22 일, 여기에서 구입할 수 있습니다.
3. "이온화 에너지." 이온화 에너지, 여기에서 사용할 수 있습니다.
이미지 제공 :
1. Orangedog의“수소 스펙트럼” - 업 로더의 자신의 작업. N '범위의 λ의 로그 플롯, N' + 1에서 N 범위는 N ' + 1에서, R은 w :rydberg constant (cc by-sa 3.0)를 통해 Wikimedia
2입니다. Sponk (PNG 파일) GLRX (SVG 파일) Wylve (Zh-Hans, Zh-Hant) Palosirkka (FI) Michel Djerzinski (vi) Tferenczy (CZ) 옵저저 (SR-EC, SR-EL, HR, BS, SH) Deepiep (ELEMENTS 104) BOB SAINT CLAR (FR). (Zh-Hans) Wiki LIC (ES) Agung Karjono (ID) Szaszicska (HU)-자체 작업에 기반한 작업 :Erste Ionisierungsenergie Pse Colored.png Commons Wikimedia







