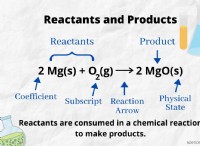
LN (P2/P1) =ΔHVAP/R * (1/T1-1/T2)
어디:
P1 =1 ATM
P2 =2.5 atm
ΔHVAP =40.7 kJ/mol (물의 기화 열기)
r =8.314 J/mol*k (가스 상수)
T1 =373 K (1 기타에서 물의 끓는점)
T2 =? (2.5 atm에서 물의 끓는점)
방정식 재배치 :우리는 다음을 얻습니다.
T2 =T1/(1 + ΔHVAP/R * (LN (P2/P1)/T1)))
값을 대체하면 다음을 얻습니다.
T2 =373 K/(1 + 40.7 kJ/mol/(8.314 J/mol * k) * (LN (2.5/1)/373 K))
T2 ≈ 384.1 k
따라서 2.5 atm의 물의 끓는점은 약 384.1k 또는 111 C입니다.