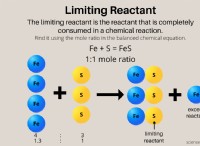
$$ 4NH_3 + 5O_2 \ RIMERARROW 4NO + 6H_2O $$
다음으로, 우리는 몰 질량을 사용하여 암모니아 몰의 수를 계산합니다.
$$ moles \ of \ nh_3 =\ frac {23.9 \ g} {17.04 \ g/mol} =1.404 \ mol $$
균형 화학적 방정식에 따르면, 4 몰의 암모니아는 5 몰의 산소와 반응합니다. 따라서 필요한 산소를 계산할 수 있습니다.
$$ moles \ of \ o_2 =1.404 \ mol \ nh_3 \ times \ frac {5 \ mol \ o_2} {4 \ mol \ nh_3} =1.755 \ mol \ O_2 $$
마지막으로, 우리는 몰 질량을 사용하여 두더지의 산소를 그램으로 다시 변환합니다.
$$ grams \ of \ o_2 =1.755 \ mol \ times 32.00 \ g/mol =56.32 \ g $$
따라서, 23.9 그램의 암모니아와 반응하려면 56.32 그램의 산소가 필요합니다.