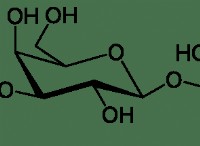
탄화수소 이해
* 기본 정의 : 탄화수소는 탄소 (C) 및 수소 (H) 원자로 만 구성된 유기 분자입니다.
* 유형 : 두 가지 주요 유형이 있습니다.
* 알칸 : 탄소 원자 (포화) 사이의 단일 결합 만 포함합니다.
* Alkenes : 탄소 원자 (불포화) 사이에 하나 이상의 이중 결합을 포함합니다.
* alkynes : 탄소 원자 (불포화) 사이에 적어도 하나의 트리플 결합을 함유한다.
탄화수소 그림
1. 탄소 백본으로 시작하십시오 :
* 선형 : 탄소 원자 (예 :C-C-C-C)의 직선을 그립니다.
* 분기 : "T"또는 "Y"접합을 사용하여 분기 (예 :C-C-C-C)를 나타냅니다.
* 순환 : 탄소 원자의 폐쇄 루프 또는 고리를 그립니다 (예 :벤젠 고리의 육각형).
2. 수소 원자를 추가 :
* 알칸 : 각 탄소 원자는 4 개의 결합이 필요합니다. 수소 원자 (H)로 나머지 결합을 채우십시오.
* alkenes/alkynes : 탄소 원자들 사이의 이중 결합 또는 삼중 결합은 각각 2 개 또는 3 개의 결합으로 계산된다는 것을 기억하십시오. 그에 따라 수소 원자 수를 조정하십시오.
3. 규칙을 따르십시오 :
* 원자가 : 탄소는 항상 4 개의 결합을 가지고 있으며, 수소는 항상 하나의 결합을 가지고 있습니다.
* 본딩 : 단일 결합은 원자 사이의 선 (-)으로 표시됩니다. 이중 결합은 2 개의 평행 라인 (=)으로, 3 개의 평행선 (≡)으로 표현됩니다.
예
* 메탄 (CH4) : 하나의 탄소 원자가있는 간단한 알칸. 단일 탄소 원자 (C)를 그리고 단일 결합을 사용하여 4 개의 수소 원자 (h)에 연결하십시오.
* ethene (C2H4) : 2 개의 탄소 원자가있는 알켄. 이중 결합으로 연결된 두 개의 탄소 원자를 그립니다. 각 탄소는 또한 양쪽에 하나의 수소 원자가 필요합니다.
* 프로판 (C3H8) : 3 개의 탄소 원자가있는 알칸. 3 개의 탄소 원자의 선을 그리고, 각 탄소의 4 개의 결합을 완성하기 위해 충분한 수소 원자를 첨가하십시오.
팁
* 응축 된 구조 공식 : 더 긴 사슬의 경우 프로판에 대한 CH3-Ch2-CH3과 같은 응축 형태로 공식을 쓸 수 있습니다.
* 라인 앵글 (골격) 구조 : 이 방법은 도면을 단순화합니다. 탄소 원자는 선의 모서리와 끝으로 표시됩니다. 수소 원자는 명시 적으로 그려지지 않습니다.
* 연습은 완벽하게 만듭니다 : 더 많이 그리울수록 쉬워집니다.
* 자원 사용 : CHEMDRAD 또는 Marvinsketch와 같은 많은 온라인 리소스와 예제와 연습 문제를 제공하는 교과서가 있습니다.
당신이 그릴 특정 탄화수소가 있다면 알려 주시면 시각화를 도울 수 있습니다!