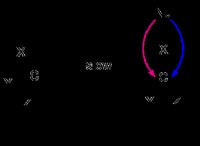
전기 분해 과정 :
1. 전해질 : 당신은 수산화 나트륨 (NAOH)의 수용액으로 시작합니다. 이 용액은 물에 용해 된 나트륨 이온 (Na+) 및 수산화 이온 (OH-)을 함유한다.
2. 전극 : 일반적으로 백금이나 흑연과 같은 불활성 재료로 만들어진 두 개의 전극이 있습니다. 하나의 전극은 양극 단자 (양극)에 연결되고 다른 전극은 음성 단자 (음극)에 연결됩니다.
3. 전류 흐름 : 전류를 적용하면 다음 반응이 발생합니다.
음극에서 * (음성 말단) :
* 감소 : 물 분자는 전자를 얻고 수소 가스 및 수산화물 이온을 형성하도록 감소됩니다.
2H⁻O + 2E₂ → H₂ (g) + 2oh⁻
* 양극 (양의 터미널) :
* 산화 : 수산화물 이온은 전자를 잃고 산화되어 산소 가스 및 물을 형성합니다.
4oh⁻ → O⁻ (g) + 2h₂o + 4e⁻
이온은 어떻게되는지 :
* 나트륨 이온 (Na+) : 나트륨 이온은이 전기 분해에서 관중 이온이다. 그들은 전극의 반응에 직접 참여하지 않습니다. 그들은 솔루션에 남아 있습니다.
* 수산화 이온 (OH-) :
음극에서 * : 수산화물 이온은 물 감소의 부산물로서 생성된다.
* 양극에서 : 수산화물 이온은 산화 반응 동안 소비된다. 그러나, 용액에서 수산화물 이온의 전체 농도는 전기 분해가 진행됨에 따라 실제로 증가된다.
중요한 메모 :
* 농도 변화 : 전기 분해 공정은 용액에서 수산화물 이온의 농도의 변화를 초래한다.
* 전극 재료 : 전극이 불활성이 아닌 경우 반응에 참여하여 다른 제품으로 이어질 수 있습니다.
* 안전 : 농축 된 나트륨 수산화 나트륨 용액의 전기 분해는 가연성 수소 가스 및 부식성 수산화물 이온의 생산으로 인해 위험 할 수 있습니다.
이 과정의 모든 측면에 대해 자세히 설명하고 싶다면 알려주세요!