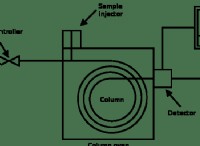
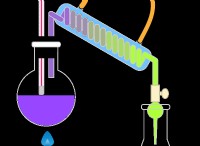
다음은 고장입니다.
1. 에너지 입력 : 액체를 가열하면 분자에 에너지를 추가합니다. 이 에너지는 운동 에너지를 증가시켜 더 빨리 움직이고 더욱 격렬하게 진동합니다.
2. 분자간 힘 극복 : 온도가 상승함에 따라 분자는 액체 상태에서 함께 유지하는 수소 결합, 쌍극자 쌍극자 상호 작용 또는 런던 분산 힘과 같은 매력을 극복하기에 충분한 에너지를 얻습니다.
3. 위상 변화 : 끓는점에서, 분자는 액체 이웃으로부터 완전히 벗어나 증기 상으로 빠져 나갈 수있는 충분한 에너지를 가지고있다. 이 위상 변화는 기화 열 라고 불리는 상당한 양의 에너지가 필요합니다. .
4. 일정한 온도 : 당신이 계속 입력하는 에너지는 나머지 액체 분자의 운동 에너지를 증가시키기보다는 더 많은 결합을 깨고 더 많은 분자를 기화시키는 데 사용됩니다. 따라서, 모든 액체가 증기로 전환 될 때까지 온도는 일정하게 유지됩니다.
본질적으로, 끓는점에서 공급되는 에너지는 온도를 증가시키지 않고 분자간 힘을 극복하고 물질 상태를 변화시키는 과정에서 전적으로 소비됩니다. . 그렇기 때문에 열이 여전히 시스템에 추가되고 있지만 끓는 동안 온도가 일정하게 유지됩니다.