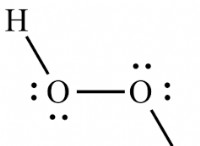
이유는 다음과 같습니다.
* 원칙 양자 번호 (n) : 3p 및 3D의 숫자는 전자의 에너지 수준을 지시하는 주요 양자 수를 나타냅니다.
* 각 운동량 양자 수 (L) : 문자 "p"와 "d"는 궤도의 모양을 나타냅니다.
* p orbitals l =1이 있고 3 개의 p 궤도가 있습니다 (px, py, pz)
* d orbitals l =2가 있고 5 개의 궤도가 있습니다.
충전 순서 :
원자 궤도의 충전 순서는 Aufbau 원칙과 헌드의 규칙을 따릅니다.
1. 낮은 에너지 수준이 먼저 채워집니다. 이것이 바로 3P가 3D 전에 오는 이유입니다.
2. 두 배가 전에 서브 쉘 내에서 개별적으로 채우는 궤도. 이것이 3D 궤도가 점유되기 전에 3 개의 3p 궤도가 채워지는 이유입니다.
따라서, 3P 궤도가 채워진 후에 채워질 다음 궤도는 3D 궤도이다.