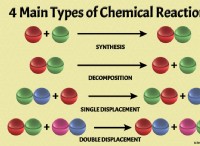
ece =(물질의 몰 질량) / (파라데이의 상수 * 전자 수)
여기서 :
* ece : 전기 화학적 등가 (쿨롱 당 그램, G/C)
* 몰 질량 : 물질의 몰 질량 (두더지 당 그램, G/mol)
* Faraday의 상수 : 1 몰의 전자 전하 (두더지 당 약 96,485 개의 쿨롱, c/mol)
* 전자 수 : 전기 분해 동안 물질의 반 반응에 관여하는 전자의 수.
예 :
구리 (CU)의 ECE를 계산합시다.
* Cu의 몰 질량 : 63.55 g/mol
* Faraday의 상수 : 96,485 c/mol
* 전자 수 : 2 (cu²⁺ + 2e⁻ → Cu)
Cu =(63.55 g/mol)/(96,485 c/mol * 2) =0.000329 g/c
따라서 구리의 전기 화학적 등가는 쿨롱 당 0.000329 그램입니다.
중요한 메모 :
* 반 반응에서 전달 된 전자의 수는 ECE를 결정하는 데 중요합니다.
* 전기 화학적 등가는 주어진 물질에 대한 기본 상수이며 현재, 시간 또는 기타 요인과 무관합니다.
* ECE는 전기 분해 중에 증착되거나 해방 된 물질의 양을 계산하는 데 사용될 수 있습니다.