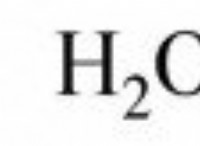1. 기본
* 철 원자 : 철 원자는 26 개의 양성자 (양전하), 26 개의 전자 (음전하) 및 일반적으로 30 개의 중성자를 갖는다. 양성자와 전자의 수가 같기 때문에 전기적으로 중립적입니다.
* 이온 제 2 철 : 제 2 철 이온 (Fe³⁺)은 3 개의 전자를 잃은 철 원자입니다. 이것은 +3의 순 양적 전하로 남겨 둡니다.
2. 과정
철 원자에서 제 2 철으로 변형은 일반적으로 산화 를 통해 발생합니다. . 간단한 설명은 다음과 같습니다.
* 전자 손실 : 철 원자는 3 개의 전자를 잃어 버린다. 이 과정에는 열, 빛 또는 화학 반응에서 발생할 수있는 에너지가 필요합니다.
* 양이온 형성 : 원자가 전자를 잃으면 양으로 하전되어 양이온이라고합니다. 이 경우, 철 원자는 제 2 철 이온이된다 (Fe³⁺).
3. 예 :Rust
일반적인 예는 녹의 형성입니다. 철분이 공기 및 수분에 노출되면 다음 반응이 발생합니다.
* 철 (Fe) + 산소 (OT) + 물 (HATER) → 산화철 (Fe₂O₃) (Rust) + 수소 (HAT)
이 반응에서, 철 원자는 산화제 (녹) 및 제 2 철 이온 (Fe³⁺)을 형성하여 산소 원자에 전자를 잃어 버린다.
4. 화학 표기법
공정에 대한 화학 표기법은 다음과 같이 쓸 수 있습니다.
* fe → fe³⁺ + 3e⁻
이것은 철 원자 (Fe)가 제 2 철 이온 (Fe³⁺)이되기 위해 3 개의 전자 (e⁻)를 잃게된다는 것을 보여준다.
요약 :
철 원자는 산화라는 공정을 통해 3 개의 전자를 잃어 버림으로써 제 2 철 이온이된다. 이것은 일반적으로 녹 형성에서와 같이 산소와 물이있는 경우에 발생합니다.