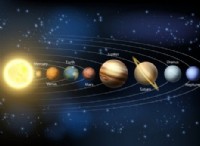
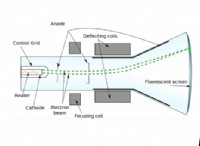
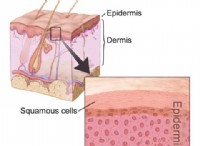
1. 정보 이해 :
* 3.0% 과산화수소 : 이것은 100g의 용액에 3.0 g의 h₂o₂가 함유되어 있음을 의미합니다.
* 1.0 g/ml의 밀도 : 이것은 1 ml의 용액의 무게가 1g임을 알려줍니다.
2. 몰비 계산 :
* h₂o₂의 몰 질량 : 2 (1.01 g/mol) + 2 (16.00 g/mol) =34.02 g/mol
* 1 L의 용액에서 h>o₂의 질량 : 밀도는 1.0 g/ml, 1 L (1000 mL)의 용액의 무게는 1000g이기 때문이다. 따라서, 1 L의 용액에는 (3.0 g H a h₂o₂ / 100 g 용액) * 1000 g 용액 =30 g h₂o₂가 포함됩니다.
* 1 L의 용액에서 HATE의 두더지 : (30 g h₂o₂) / (34.02 g / mol) =0.882 mol h₂o₂
* Molarity (m) : 몰비는 용액의 리터당 용질의 두부로 정의됩니다. 따라서, 용액의 몰토리성은 0.882 mol/L 또는 0.882 M이다.
따라서, 3.0% 과산화수소 수용액의 몰토리성은 약 0.882 m입니다.