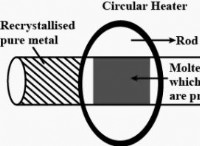
설명 :
* 이온 결합 대 공유 결합 : KCl은 이온 성 화합물이고, HCl은 공유 화합물이다. 이온 성 화합물은 반대로 하전 된 이온들 사이에 강한 정전기 인력을 가지며, 이는 극복하기 위해 상당한 양의 에너지가 필요하다. 공유 화합물은 쌍극자 쌍극자 상호 작용 또는 런던 분산 힘과 같은 약한 분자간 힘을 갖는다.
* 격자 에너지 : KCl은 K+와 클리온 사이의 강한 정전기 관광 명소로 인해 높은 격자 에너지를 가지고 있습니다. 이 높은 격자 에너지는 이온 결합을 깨고 화합물을 녹이기가 어렵습니다.
* 극성 : HCl은 극성 분자이지만, HCl 분자 사이의 쌍극자-쌍극자 상호 작용은 KCl의 이온 결합보다 훨씬 약하다.
용융점 :
* KCL :770 ° C (1418 ° F)
* HCL :-114.2 ° C (-173.6 ° F)
따라서, 강한 이온 결합 및 높은 격자 에너지로 인해, KCl은 HCl보다 상당히 높은 용융점을 갖는다.