용해도 이해
* "원리 :처럼 녹는 것처럼 이것은 화학의 근본적인 경험 법칙입니다. 극성이 비슷한 물질은 서로 녹는 경향이 있습니다.
* 극성 : 분자의 극성은 전자 밀도의 분포를 설명합니다. 극성 분자는 고르지 않은 전하 분포를 가지고있어 양성과 부정적인 목적을 만듭니다. 비극성 분자는 전자 밀도를 고르게 분포시켰다.
구성 요소를 분석하겠습니다 :
* KCl, KF, KBR : 이들은 모두 이온 성 화합물이다 . 그것들은 금속 양이온 (K+)과 비금속 음이온 (Cl-, f-, br-)으로 구성됩니다. 이온 성 화합물은 일반적으로 매우 극성입니다 이온들 사이의 강한 정전기 인력으로 인해.
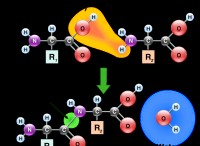
* Tetrahydrofuran (thf) : THF는 주기적 에테르입니다. 산소 원자로 인해 극성 특성을 가지고 있지만 주로 비극성으로 간주됩니다. .
문제 :
이온 성 화합물 (KCl, KF, KBR)의 강한 극성은 THF의 비극성 특성과의 불일치입니다. 극성의 이러한 비 유사성은 효과적인 용 매화를 방지합니다. THF 분자는 이온을 효과적으로 둘러싸고 안정화시켜 용해를 방해 할 수 없습니다.
키 포인트 :
* 극성 용매 : 이온 성 화합물을 용해 시키려면 일반적으로 물 (H2O) 또는 에탄올 (C2H5OH)과 같은 극성 용매가 필요합니다. 이 용매는 이온과의 강한 상호 작용을 형성하여 분리하여 용해시킬 수 있습니다.
* 예외 : "Dike Like Like"규칙에는 예외가 있습니다. 일부 극성 분자는 런던 분산 힘과 같은 약한 상호 작용으로 인해 비극성 용매에 제한된 범위로 용해 될 수 있습니다. 그러나 THF의 KCl, KF 및 KBR의 경우 이는 중요하지 않을 것입니다.
요약 :
KCL, KF 및 KBR은 극성의 성질과 THF의 비극성 특성으로 인해 테트라 하이드로 푸란 (THF)에 잘 녹지 않을 것입니다.