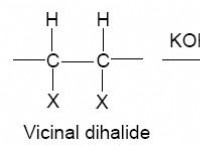
다음은 다음과 같은 방법입니다.
1. 경험적 공식을 결정하십시오 :
* 각 요소의 두더지를 계산합니다 :
-N =14.01 g/mol의 몰 질량
-H =1.01 g/mol의 몰 질량
-Cl =35.45 g/mol의 몰 질량
-N =(51.5 g NH2Cl) * (14.01 g n/mol nh2cl) =3.61 mol n
-H =(51.5 g NH2CL) * (2 * 1.01 g H/mol NH2CL) =103.1 g H
-Cl =(51.5 g NH2CL) * (35.45 g Cl/mol NH2CL) =18.25 mol Cl
* 두더지의 가장 간단한 전체 수비 비율을 찾으십시오 :
- 각 몰 수를 가장 적은 수의 두더지 (3.61 mol n)로 나눕니다.
-N :3.61 mol / 3.61 mol =1
-H :103.1 mol / 3.61 mol ≈ 28.5 ≈ 29
-CL :18.25 mol / 3.61 mol ≈ 5.05 ≈ 5
* 경험적 공식은 NH29Cl5 입니다
2. 분자식을 결정하십시오 :
* 경험적 공식의 몰 질량을 계산합니다.
-NH29Cl5의 몰 질량 ≈ (14.01 + 29 * 1.01 + 5 * 35.45) g/mol ≈ 231.5 g/mol
* 주어진 어금니 질량을 경험적 공식 몰 질량으로 나눕니다.
-51.5 g/mol/231.5 g/mol ≈ 0.22
* 이 값은 1/5에 가깝기 때문에 분자식을 얻기 위해 경험적 공식의 위시에 5를 곱합니다.
NH2CL의 분자 공식은 NH145Cl25. 입니다
중요한 참고 : 화합물이 많은 수소와 염소 원자를 갖는 것은 매우 드문 일입니다. 제공된 몰 질량 (51.5 g)이 부정확 할 수 있습니다. 제공된 정보를 다시 확인하십시오.