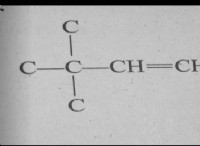
반응 :
HCl과 Na로 코 사이의 반응은 다음과 같습니다.
2HCl (aq) + na₂o₃ (aq) → 2NaCl (aq) + H₂O (l) + Co₂ (g)
중탄산염의 역할 :
등가 지점에서 모든 Na로 코스가 반응했으며 NaCl을 포함하는 솔루션과 HATE와 CO₂ 사이의 반응 산물이 남아 있습니다. 이 반응은 탄산산 (H₂Co₃)을 형성합니다.
co₂ (g) + h go (l) ⇌ h₂o₃ (aq)
탄산은 약산입니다. 그것은 부분적으로 중탄산염 (HCO₃⁻)과 수소 이온 (H⁺)으로 분리됩니다.
h₂co₂ (aq) ⇌ h⁺ (aq) + hco₃⁻ (aq)
약간 산성 성질 :
반응이 처음에 모든 HCL을 중화 시키지만, 중탄산염 이온 인 HCO₃⁻의 존재는 약간의 산도를 초래한다. 중탄산염은 약산으로 작용하여 물에 양성자를 기증 할 수 있습니다.
hco + (aq) + h₂o (l) ⇌ h₃o⁺ (aq) + co₃²⁻ (aq)
중탄산염 분리로부터 생성 된이 소량의 HATE는 용액을 약간 산성으로 만듭니다.
요약 :
반응 화학량 론은 등가 지점에서 중성 용액을 시사하지만, 탄산산 및 그 후의 약산 해리의 형성은 약간의 과량의 HALE 이온을 초래하여 약간 산성 용액을 초래한다.