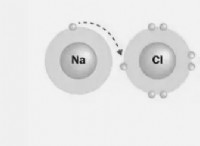
알칼리 금속과 할로겐의 차이 :
알칼리 금속과 할로겐은주기적인 표에있는 그룹이지만 특성에는 상당한 차이가 있습니다.
1. 주기율표의 위치 :
* 알칼리 금속 : 그룹 1, 첫 번째 열.
* 할로겐 : 그룹 17, 두 번째 ~ 마지막 열.
2. 전자 구성 :
* 알칼리 금속 : 가장 바깥 쪽 쉘에 하나의 원자가 전자를 두십시오 (NS¹).
* 할로겐 : 가장 바깥 쪽 껍질에 7 개의 원자가 전자가 있습니다 (NS²NP⁵).
3. 반응성 :
* 알칼리 금속 : 반응성이 높으면 원자가 전자를 쉽게 잃어 +1 양이온을 형성합니다.
* 할로겐 : 또한 반응성이 높고, 하나의 전자를 쉽게 얻어 -1 음이온을 형성한다.
4. 물리적 상태 :
* 알칼리 금속 : 더 단단한 리튬을 제외하고는 실온에서 부드럽고 은빛 흰색 금속.
* 할로겐 : 실온에서 세 가지 상태 모두에 존재합니다 :고체 (요오드), 액체 (브롬) 및 가스 (불소, 염소).
5. 용융 및 끓는점 :
* 알칼리 금속 : 녹는 점과 비등점이 낮아서 그룹을 줄입니다.
* 할로겐 : 알칼리 금속보다 녹는 점과 비등점이 높아서 그룹이 증가합니다.
6. 이온화 에너지 :
* 알칼리 금속 : 낮은 이온화 에너지는 전자를 쉽게 잃게됩니다.
* 할로겐 : 높은 이온화 에너지는 전자를 강력하게 유지한다는 것을 의미합니다.
7. 전자 친화력 :
* 알칼리 금속 : 낮은 전자 친화력은 전자를 쉽게 얻지 못한다는 것을 의미합니다.
* 할로겐 : 높은 전자 친화도는 전자를 쉽게 얻습니다.
8. 발생 :
* 알칼리 금속 : 자연에서 화합물로 발견되며, 원소 형태는 없습니다.
* 할로겐 : 자연에서 화합물로, 또한 이원성 분자 (예 :Cl₂, br₂)로도 발견됩니다.
9. 용도 :
* 알칼리 금속 : 배터리, 전구 및 기타 응용 프로그램에 사용됩니다.
* 할로겐 : 소독제, 표백제 및 기타 응용 분야에 사용됩니다.
요약하면, 알칼리 금속은 하나의 원자가 전자를 갖는 고도로 반응성 금속이고, 할로겐은 7 개의 원자가 전자를 가진 고도로 반응성 비금속이다. 전자 구성의 이러한 차이는 이러한 그룹의 대조적 인 특성과 용도로 이어집니다.