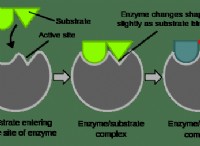
* 염기성 : 염기성은 종의 양성자 (H⁺)를 수용하는 능력을 말합니다. 더 강한 염기는 양성자를 받아 들일 가능성이 높습니다.
* 염기성에 영향을 미치는 요인 : 이온의 기본성에 몇 가지 요소가 기여합니다.
* 전기 음성 : 더 많은 전기 음성 원자는 전자를 더 단단히 고정시켜 기증 할 가능성이 적고 기본이 덜합니다. 산소는 황보다 더 전기 음성입니다.
* 크기 : 더 큰 원자는 원자가 전자를 핵으로부터 더 추가하여 기증 될 가능성이 높아서 더 기본적이다. 황은 산소보다 큽니다.
* 충전 : 음전하가 많을수록 양성자를 끌어들이는 능력이 증가하여 종을보다 기본적으로 만듭니다. 설파이드와 질산염 모두 -2 전하가 있습니다.
* 이러한 요소 적용 :
* 설파이드 이온 (s²⁻) : 황의 크기와 -2 전하는 더 강한베이스가됩니다.
* 질산 이온 (No₃⁻) : 산소의 전기 음성은 전자를 기증 할 가능성이 적기 때문에 기본이 덜합니다. 또한, 질산염 이온 내의 전자의 탈소 화는 기본 성을 더욱 감소시킨다.
요약하면, 황화물 이온은 산소에 비해 황의 더 큰 크기와 덜 전기 음성 특성으로 인해 질산염 이온보다 더 강한 염기입니다.