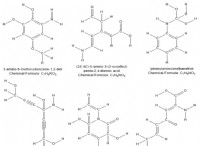
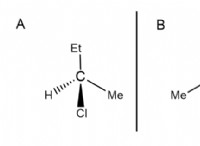
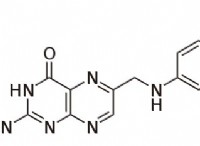
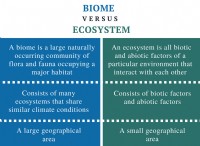
1. 농도 구배 및 엔트로피 :
* 농도 구배는 낮은 엔트로피 상태를 나타냅니다 . 농도가 높을 수있는 막의 측면에있는 분자는 더 순서가 더 높고, 농도가 낮은 측면에있는 분자는 더 분산된다.
* 확산은 엔트로피를 증가시키는 경향이있다 고농도의 영역에서 저농도의 영역으로 분자를 이동함으로써. 이것은 더 고르게 분산되고 덜 순서가없는 상태를 만듭니다.
2. 자발적인 움직임 :
* 두 번째 법칙은 프로세스가 시스템의 전체 엔트로피를 증가시킬 경우 자발적으로 발생한다고 지시합니다.
* 막을 가로 지르는 확산은 엔트로피가 증가하기 때문에 자발적인 과정입니다. 분자는 더욱 장애가되고 전체 시스템은 더 무작위로됩니다.
3. 자유 에너지 :
* 두 번째 법칙은 자유 에너지 측면에서 표현 될 수 있으며, 이는 일을 할 수있는 에너지입니다. 시스템은 자발적으로 자유 에너지가 낮은 상태로 이동합니다.
* 확산시, 농도 구배가 소산됨에 따라 시스템의 자유 에너지가 감소하여 프로세스가 유리하게 만듭니다.
4. 막과 장벽 :
* 멤브레인은 확산의 장벽으로 작용할 수 있지만 완전히 막을 수는 없습니다.
* 두 번째 법칙은 여전히 적용되지만 확산 속도는 막 투과성, 분자 크기 및 농도 구배의 크기와 같은 요인에 의해 영향을받습니다.
요약 :
열역학의 제 2 법칙은 엔트로피를 증가시키는 시스템을 주도함으로써 막을 통한 확산이 자발적으로 발생하는 이유를 설명합니다. 그것은 고농도의 영역에서 저농도로 분자의 움직임을 선호하여 더욱 무질서하고 에너지 상태가 덜 발생합니다.