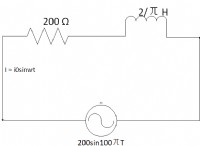
* 이온 결합 : 이온 성 화합물은 양으로 하전 된 이온 (양이온)과 음의 하전 이온 (음이온) 사이의 정전기 인력에 의해 형성된다. 그들은 공유 화합물과 같은 개별 분자를 형성하지 않습니다.
* 격자 구조 : 분자 대신, 이온 성 화합물은 연장 된 3 차원 격자로서 존재한다. 이 구조에서, 이온은 규칙적이고 반복되는 패턴으로 배열된다.
* 경험적 공식 : 이온 성 화합물은 그들의 경험적 공식으로 표현된다 , 이것은 존재하는 이온의 가장 간단한 전체 수치를 보여줍니다. 이 공식은 개별 분자의 구성이 아니라 격자에서의 이온의 비율을 반영합니다.
예 :
* 염화나트륨 (NaCl) : 경험적 공식은 결정 격자의 모든 클로라이드 이온 (Cl-)에 대해 하나의 나트륨 이온 (Na+)을 나타냅니다. 뚜렷한 "NaCl 분자"는 없습니다.
요약 : 이온 성 화합물은 분자 공식이 결여되어 이산 분자로 존재하지 않고 이온의 확장 된 격자로 존재하기 때문입니다. 그들의 구성은 경험적 공식으로 표현되며, 이는 격자에서 가장 간단한 전체 수의 이온 비율을 나타냅니다.