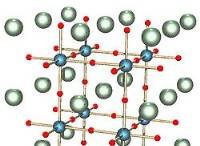
고체로서 염화나트륨 (NaCl) 및 산화 마그네슘 (MGO)의 구조 :
염화나트륨 (NaCl)과 산화 마그네슘 (MGO)은 모두 이온 성 화합물입니다 결정 격자 구조 . 이것은 그들의 구성 이온이 고도로 순서가 높은 반복 패턴으로 배열된다는 것을 의미합니다.
염화나트륨 (NaCl) :
* 결정 구조 : 얼굴 중심 입방 (FCC) 격자.
* 이온 배열 : 나트륨 양이온 (Na+) 및 클로라이드 음이온 (CL-)은 1 :1 비율로 교대합니다. 각 이온이 반대 전하의 6 개 이온으로 둘러싸인 3D "바둑판"패턴을 상상해보십시오.
* 본딩 : 반대로 하전 된 이온 사이의 강한 정전기 인력.
* 속성 : 높은 용융 및 끓는점, 단단하고 부서지기 쉬운 물에 용해됩니다.
산화 마그네슘 (MGO) :
* 결정 구조 : NaCl과 유사하며 얼굴 중심 입방 격자가 있습니다.
* 이온 배열 : 마그네슘 양이온 (MG2+) 및 산화물 음이온 (O2-)은 1 :1 비율로 교대합니다. 그러나, 배열은 이온의 다른 전하로 인해 NACL과 약간 다릅니다.
* 본딩 : 이온의 더 높은 전하로 인해 NaCl보다 더 강한 정전기 인력.
* 속성 : 매우 높은 용융 및 끓는점, 매우 단단하고 부서지기 쉬운 물에 불용성.
유사성 :
* 둘 다 입방 결정 구조를 가지고 있습니다.
* 둘 다 강한 정전기력을 가진 이온 성 화합물입니다.
* 강한 이온 결합으로 인해 녹는 점과 비등점이 높습니다.
차이점 :
* 이온의 크기 : Mg2+ 및 O2-는 Na+ 및 Cl-보다 작으며, MGO에서 밀도가 높다.
* 이온의 전하 : Mg2+ 및 O2-는 Na+ 및 Cl-보다 높은 전하를 가지며, 이는 MGO에서 더 강한 정전기력과 더 높은 융점을 초래한다.
* 용해도 : NaCl은 물에 용해되지만 MGO는 불용성입니다.
요약하면, NaCl과 MgO는 유사한 결정 구조를 가지지 만, 이온 크기와 전하의 차이는 특히 융점 및 용해도 측면에서 다른 특성을 초래한다.